このページのまとめ
- 緩衝溶液は、pHを一定に保つために使われる溶液で、弱酸とその共役塩基、または弱塩基とその共役酸の組み合わせでできている。
- 酸や塩基が加わったときに、中和することでpHの変化を防ぐ。
- 緩衝作用はpKaに近いpHの範囲で最も強く働く。
- 血液や化学実験、酵素反応など、広い範囲で使用されている。
~先生と生徒の会話~
 生徒
生徒緩衝溶液って何に使われるのか、よく聞くけど実際にどんな役割を持っているんですか?



緩衝溶液は、外から酸や塩基が加えられても、pHを大きく変えないようにする働きがあるんだ。これが非常に役立つ場面は多いんだよ。たとえば、生物の体内では血液のpHが一定に保たれているけど、これは緩衝溶液の働きが大きいんだ。もしpHが急激に変わってしまうと、体の機能がうまく働かなくなってしまうからね。



体内でも使われているんですね!でも、どうして緩衝溶液はpHを保てるんですか?



良い質問だね!緩衝溶液は、弱酸とその共役塩基、または弱塩基とその共役酸の組み合わせでできているから、酸が加えられても塩基がそれを打ち消す、逆に塩基が加えられても酸がそれを打ち消す仕組みになっているんだ。たとえば、酢酸(CH₃COOH)とその共役塩基である酢酸ナトリウム(CH₃COONa)を混ぜた溶液を考えてみよう。
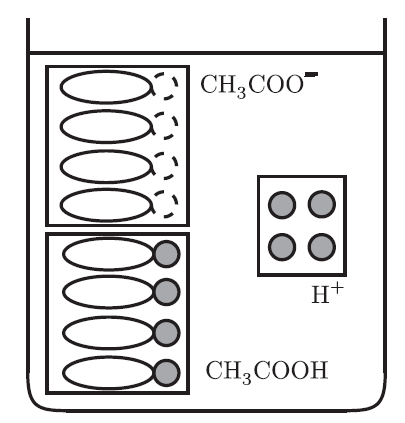




酸が加わった場合、酢酸ナトリウムが加えられたH⁺(水素イオン)を中和してくれる。逆に、塩基が加わった場合は、酢酸が水酸化物イオン(OH⁻)と反応して中和するから、pHの変化が抑えられるんだよ。
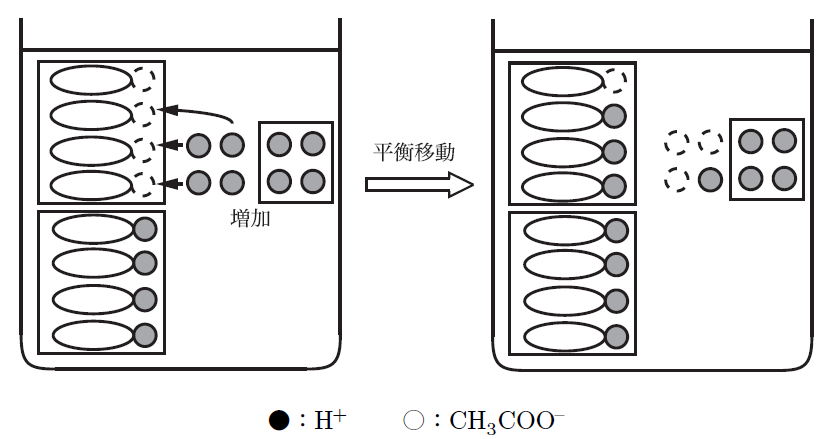

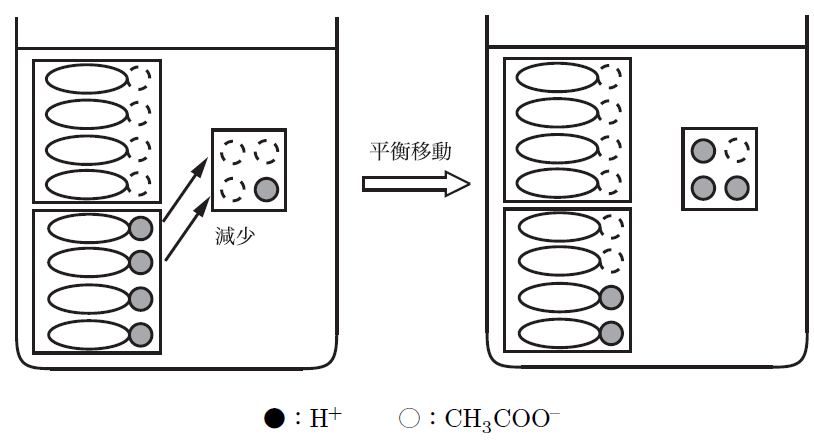




なるほど!酸や塩基が加わっても、その分だけ反応してpHを保つ仕組みなんですね。そういう意味で「緩衝」って言うんですね。



その通りだよ!それに、この緩衝作用はどの範囲のpHで最も効果的に働くかが決まっていて、これは緩衝溶液を作るときに使う酸や塩基の「pKa」や「pKb」と呼ばれる値に関係しているんだ。緩衝溶液はpHがpKa値に近いところで最も効果的に働くんだよ。



pKaというのは、酸がどれだけ電離しやすいかを示す値でしたよね?その値が近いと、どうして緩衝作用が強くなるんですか?



pKaは、まさに酸の電離しやすさを示すんだけど、pHがpKaと同じくらいだと、酸とその共役塩基がほぼ同じ量存在する状態になるんだ。これによって、外から酸や塩基が加えられても、どちらも効果的に反応できるから、緩衝作用が最も強くなるんだ。



pKaに近いpHの範囲で、どちらも十分に働くってことですね。じゃあ、具体的に緩衝溶液ってどんな場面で使われるんですか?



一番身近な例は、さっき言ったように血液だね。血液は炭酸水素塩(HCO₃⁻)と二酸化炭素(CO₂)が関わる緩衝系によって、pHが7.4程度に保たれているんだ。この緩衝機能のおかげで、食べ物や飲み物から酸や塩基が体に入ってきても、すぐにpHが変わってしまうことがないんだ。



他にも、化学実験で使う緩衝溶液も重要だよ。例えば、pHが非常に敏感な反応を行うときに、緩衝溶液を使って反応のpHを一定に保つことで、反応がうまく進むようにするんだ。酵素反応や、薬品の製造などでも緩衝溶液は欠かせないよ。
例題&解答
【例題1】
次の溶液のどの組み合わせから緩衝溶液を作ることができますか?
1. 酢酸(CH₃COOH)と酢酸ナトリウム(CH₃COONa)
2. 塩酸(HCl)と硝酸ナトリウム(NaNO₃)
【解答】
酢酸と酢酸ナトリウムは、弱酸とその共役塩基の組み合わせであるため、緩衝溶液を作ることができる。
塩酸は強酸であり、共役塩基も非常に弱いため、緩衝溶液を作ることはできない。
【例題2】
次のpHにおける緩衝作用の強さを比較しなさい。pKa = 4.76の酢酸を用いた緩衝溶液
1. pH = 4.76
2. pH = 6.0
【解答】
pHが4.76の場合、酸と共役塩基の量がほぼ等しいため、緩衝作用が最も強く働く。
pHが6.0の場合、酢酸よりも共役塩基が多くなり、緩衝作用は弱くなる。













