このページのまとめ
- 塩の加水分解は、弱酸や弱塩基が水に溶けると、溶液が酸性や塩基性に変化する現象。
- 弱酸と強塩基からできた塩は、加水分解で塩基性になる。
- 強酸と弱塩基からできた塩は、加水分解で酸性になる。
- 強酸と強塩基の塩は加水分解せず、中性を保つ。
~先生と生徒の会話~
 生徒
生徒塩が水に溶けるときにpHが変わることがあると聞きましたが、それって「加水分解」と関係があるんですか?



その通りだね!「塩の加水分解」という現象が関係しているんだ。塩が水に溶けると、その塩がもともとどんな酸と塩基からできたかによって、溶液が酸性、塩基性、あるいは中性になるんだよ。塩の加水分解というのは、塩が水と反応して、酸性や塩基性の成分を作り出すことを指しているんだ。



具体的には、どんな塩が加水分解するんですか?



例えば、弱酸と強塩基からできた塩が代表的だね。酢酸ナトリウム(CH₃COONa)を水に溶かすと、酢酸(CH₃COOH)と水酸化ナトリウム(NaOH)が加水分解によって生成される。この場合、酢酸は弱酸で完全には電離しないけれど、ナトリウムイオン(Na⁺)は水に溶けても反応しないため、水溶液は塩基性になるんだ。
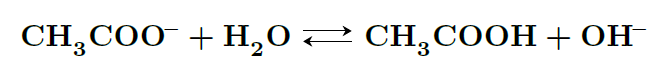




逆に、強酸と弱塩基からできた塩、たとえば塩化アンモニウム(NH₄Cl)は、水に溶けるとアンモニア(NH₃)と塩酸(HCl)が生成される。この場合、アンモニアは弱塩基で完全には電離しないけれど、塩酸は強酸だから溶液が酸性になるんだよ。



なるほど!弱酸や弱塩基が関わる塩が加水分解を引き起こすんですね。それじゃあ、強酸と強塩基からできた塩はどうなりますか?



強酸と強塩基からできた塩、たとえば塩化ナトリウム(NaCl)なんかは、水に溶けても加水分解が起こらないんだ。NaClはNa⁺とCl⁻に分かれるけど、どちらも水に溶けても反応しないイオンだから、溶液は中性になる。だから、強酸と強塩基の組み合わせでは、pHは変わらずに中性のままだね。



酸や塩基の強さが加水分解に影響するんですね。でも、どうして弱酸や弱塩基の塩だけが加水分解するんですか?



それは、弱酸や弱塩基は水中で完全には電離しないからなんだ。弱酸の塩が水に溶けると、その塩の陰イオンは水と反応して水酸化物イオン(OH⁻)を生成する。弱塩基の塩の場合は、塩の陽イオンが水と反応して水素イオン(H⁺)を生成するから、水溶液が酸性になるんだよ。電離の程度が関わっているから、弱い酸や塩基が含まれる塩だけが加水分解を引き起こすんだ。



なるほど、電離しにくい弱酸や弱塩基の塩が加水分解することで、溶液が酸性や塩基性になるんですね!この仕組みを利用する場面ってどんなところですか?



一つの例は、工業プロセスや食品加工におけるpH調整だね。塩の加水分解を使って、溶液の酸性度や塩基性を調整できる。例えば、酸性の環境が必要な発酵プロセスでは、塩化アンモニウムを使ってpHを下げることができるし、塩基性が求められる反応では酢酸ナトリウムが役立つんだよ。また、緩衝溶液を作るときにも、塩の加水分解を利用してpHを一定に保つことができるんだ。
例題&解答
【例題1】
次の塩の加水分解によって、生成される溶液が酸性、塩基性、中性のどれになるか答えなさい。
1. 酢酸ナトリウム(CH₃COONa)
2. 塩化アンモニウム(NH₄Cl)
3. 硫酸ナトリウム(Na₂SO₄)
【解答】
- 酢酸ナトリウムは弱酸と強塩基からできた塩で、加水分解によって塩基性の溶液が生成される。
- 塩化アンモニウムは強酸と弱塩基からできた塩で、加水分解によって酸性の溶液が生成される。
- 硫酸ナトリウムは強酸と強塩基からできた塩で、加水分解しないため中性の溶液になる。
【例題2】
0.1 mol/Lの塩化アンモニウム(NH₄Cl)水溶液のpHが酸性になる理由を説明しなさい。
【解答】
塩化アンモニウムは、強酸である塩酸(HCl)と弱塩基であるアンモニア(NH₃)からできた塩である。NH₄⁺が水と反応してH⁺を生成するため、溶液が酸性になる。













