このページのまとめ
- 滴定曲線は、滴定におけるpHの変化をグラフで表したもの。
- 強酸と強塩基の滴定では、S字型の曲線が描かれ、急激なpHの変化が起こる中和点がある。
- 強酸と弱塩基、または強塩基と弱酸の場合、pHの変化が緩やかになり、中和後のpHも酸性や塩基性に偏る。
- 滴定曲線を使って、酸や塩基の強弱や反応の特徴を分析することができる。
~先生と生徒の会話~
 生徒
生徒中和滴定の話は理解できましたが、「滴定曲線」というのはどういうものなんですか?



滴定曲線は、酸や塩基の滴定を進めていくときのpHの変化をグラフにしたものだよ。縦軸にpH、横軸に加えた酸や塩基の量(通常は体積)をとったグラフで、pHの変化を視覚的に捉えることができるんだ。これを見ると、中和がどのように進んでいるのかが一目でわかるんだよ。



グラフで見るんですね!具体的にどういう形になるんですか?



たとえば、強酸と強塩基を使った滴定では、最初はpHが急激に変わらず、一定のpHを保つけど、滴定が進むにつれて急激にpHが上がる瞬間が出てくるんだ。この急激に変化するところが「中和点」と呼ばれる部分で、ここで酸と塩基がちょうど中和されるんだよ。中和点に到達すると、pHの変化は緩やかになっていく。グラフで言えば、S字型の曲線を描くんだ。
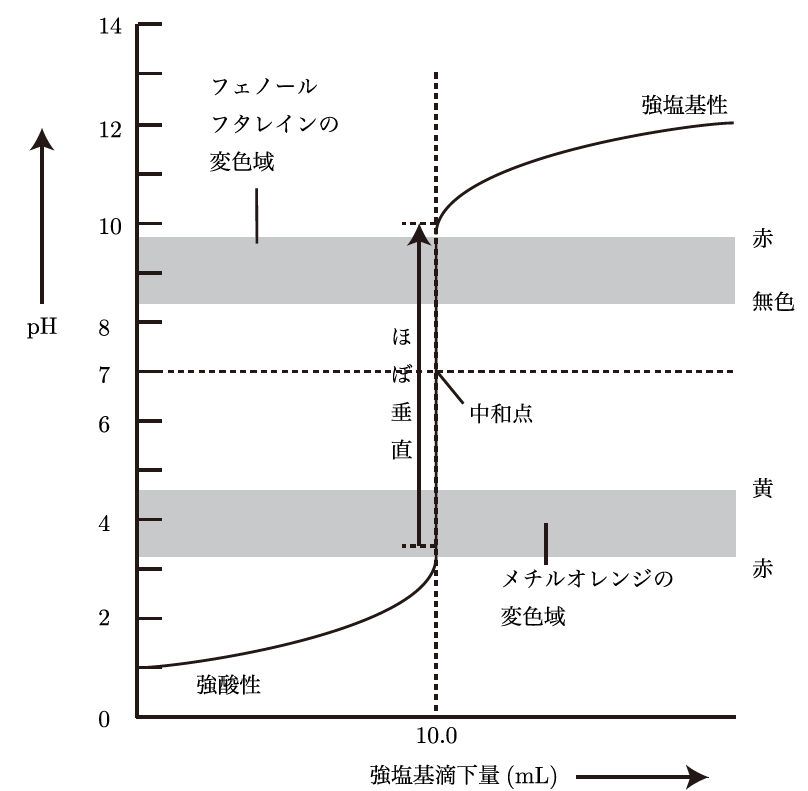




なるほど!最初はあまり変わらなくて、ある点で急に変わるんですね。それが中和点なんですね。でも、強酸と弱塩基の場合だと、滴定曲線はどうなるんですか?



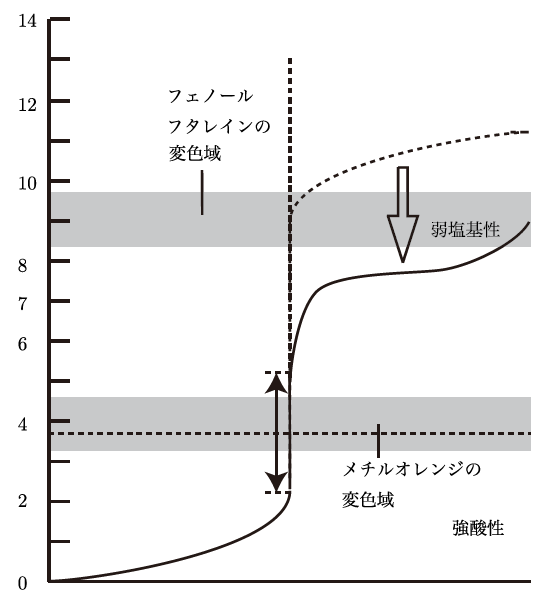
いい質問だね!強酸と弱塩基の場合は、強酸と強塩基のときと少し異なる曲線になるよ。最初の部分は同じようにゆっくりと変化するけど、中和点付近でのpHの急激な変化はやや緩やかになるんだ。また、完全な中和後のpHも、中性(pH 7)より低めの酸性になることが多いんだよ。




逆に、強塩基と弱酸の組み合わせだと、最初のpHが高めで、中和後のpHは塩基性に偏る。だから、滴定曲線は滴定する酸や塩基の強弱によって形が変わるんだ。
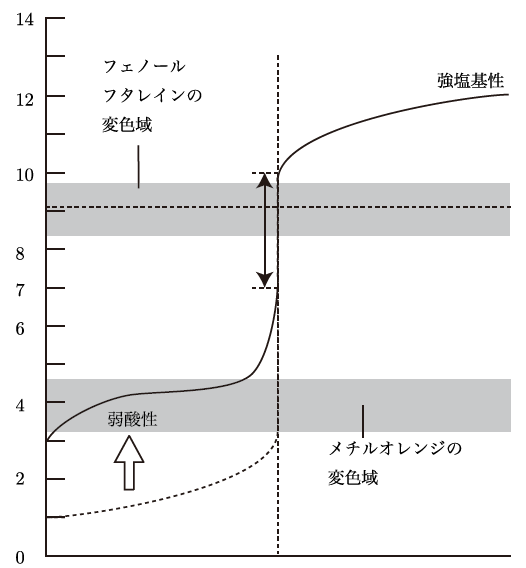




酸や塩基の強さが滴定曲線に影響するんですね!それって、どうして曲線が違ってくるんですか?



それは、酸や塩基の電離の程度が関係しているんだ。強酸や強塩基はほぼ完全に電離するから、中和反応が進むと一気にpHが変わるんだ。一方、弱酸や弱塩基は部分的にしか電離しないから、pHの変化が緩やかになって、滴定曲線の形が変わってくるんだよ。



滴定曲線を使うと、酸や塩基の強さや濃度の違いが一目でわかるんですね!じゃあ、実験で滴定曲線を作るときは、pHメーターを使って測るんですか?



そうだね、pHメーターを使って正確に測定するのが一般的だよ。ビュレットを使って酸や塩基を少しずつ加えながら、pHメーターでpHの変化を記録していくんだ。そのデータを基に、滴定曲線を描くことができるんだよ。滴定曲線を使えば、中和点を正確に見つけるだけでなく、反応の特徴も詳しく分析できるんだ。
例題&解答
【例題1】
次の条件で行われた滴定の滴定曲線の形状を予想しなさい。
0.1 mol/Lの塩酸(HCl)50 mLを0.1 mol/Lの水酸化ナトリウム(NaOH)で滴定した場合。
【解答】
HClとNaOHは強酸と強塩基の組み合わせであるため、滴定曲線はS字型の曲線を描く。中和点では急激にpHが変化し、pHはおおよそ7になる。
【例題2】
次の条件で行われた滴定の滴定曲線の形状を予想しなさい。
0.1 mol/Lの酢酸(CH₃COOH)50 mLを0.1 mol/Lの水酸化ナトリウム(NaOH)で滴定した場合。
【解答】
酢酸は弱酸で、NaOHは強塩基であるため、滴定曲線は中和点付近で急激にpHが変化するが、完全中和後のpHは塩基性に寄る。また、最初のpHは強酸の場合よりも高めから始まる。













