このページのまとめ
- 中和は、酸と塩基が反応して水を生成する反応で、理想的にはpHが7になる。
- 中和滴定は、酸や塩基の濃度を正確に測るための実験手法で、滴定によって中和点を見つける。
- 指示薬やpHメーターを使って、中和が完了した瞬間を判断し、濃度を計算する。
~先生と生徒の会話~
 生徒
生徒酸と塩基が反応して「中和」すると聞いたんですが、具体的にはどんな反応が起きているんですか?



中和は、酸が放出する水素イオン(H⁺)と塩基が放出する水酸化物イオン(OH⁻)が結びついて、水(H₂O)を生成する反応なんだ。たとえば、塩酸(HCl)と水酸化ナトリウム(NaOH)を反応させると、次のような反応が起きる。



HCl + NaOH → NaCl + H₂O



この反応では、酸(HCl)と塩基(NaOH)が反応して、食塩(NaCl)と水ができる。水が生成されることが中和の特徴で、この反応では酸と塩基の性質が互いに打ち消し合うんだよ。



なるほど!酸と塩基が反応して水ができるんですね。じゃあ、中和する時のpHはどうなるんですか?



いい質問だね!中和反応が完全に進むと、理想的にはpHは中性の7になるんだ。これは、H⁺とOH⁻がちょうど同じ量で反応し、水だけが残るためなんだ。でも、実際には酸や塩基の強さや濃度によって、中和後のpHが少し酸性寄りや塩基性寄りになることもあるんだよ。強酸と弱塩基、あるいは強塩基と弱酸が中和するときは、pHが中性から外れることがあるんだ。



ああ、だから中和反応によってpHが完全に7になるとは限らないんですね。ところで、「中和滴定」ってよく実験で聞くんですが、これは何をする実験なんですか?



中和滴定は、酸や塩基の濃度を正確に測るために使われる実験なんだ。具体的には、酸の濃度を知りたいときには、その酸に適量の塩基を少しずつ加えていき、完全に中和するまでの塩基の量を測るんだ。このとき、pHの変化を監視するために指示薬を使ったり、pHメーターを使ったりすることが多いんだよ。指示薬はpHの変化によって色が変わるので、色の変化を見て、中和点に到達したかどうかがわかるんだ。



滴定することで、酸や塩基の濃度を知ることができるんですね!指示薬の色が変わるところで中和点がわかるんですか?



そうだね!例えば、フェノールフタレインという指示薬を使うと、pHが中性を超えて塩基性になると色がピンクに変わるんだ。だから、ピンク色に変わる瞬間が中和点に到達したというサインなんだよ。そこから、使った塩基や酸の量を計算して、もとの酸や塩基の濃度を求めることができるんだ。他にも、メチルオレンジという指示薬があって、酸性寄りになると赤色を示す性質があるよ。
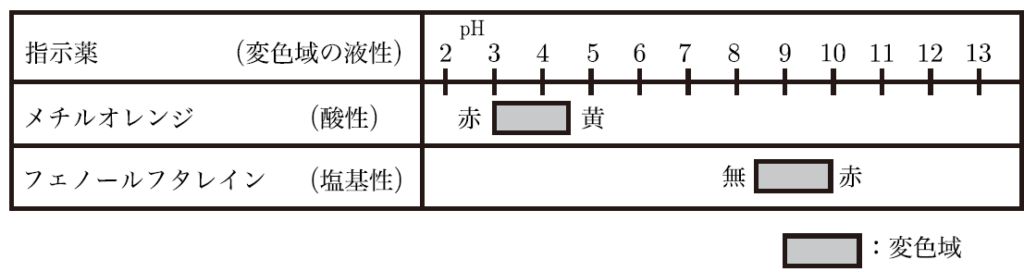




実際の実験では、ビュレットを使って塩基を少しずつ滴下しながら、溶液の色の変化やpHメーターの読み取りを行うんだ。中和滴定は、酸や塩基の濃度を正確に知るためのとても便利な方法なんだよ。
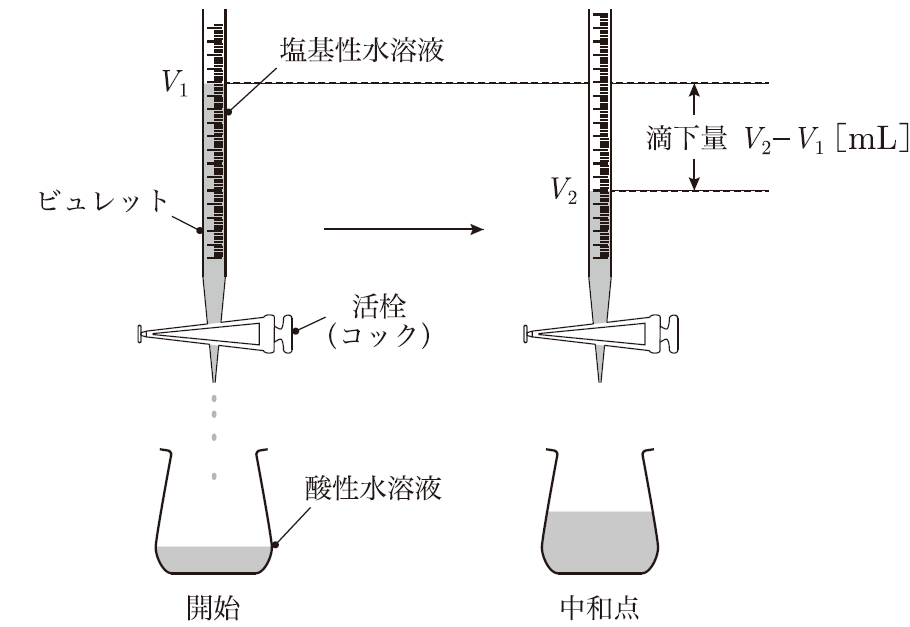




中和滴定って、見た目にもわかりやすくて面白そうですね!でも、どうやって正確に濃度を計算するんですか?



中和滴定では、酸と塩基がどのくらいの量で反応したかを基に、濃度を計算することができる。反応は基本的に「モル比」に基づいて進むから、使った酸や塩基の量をモル数で計算して、以下の式を使うんだ。
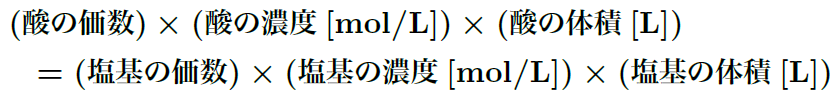
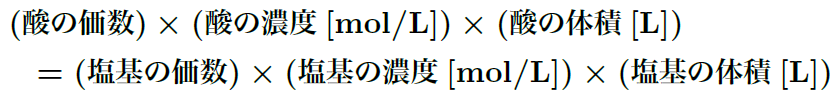



この式をもとに、滴定に使った塩基の体積と濃度から、未知の酸の濃度を求めることができるんだ。もちろん、逆に塩基の濃度を求めたい場合も同じ原理で計算できるよ。
例題&解答
【例題1】
0.1 mol/Lの水酸化ナトリウム(NaOH)溶液1Lを用いて、0.05 mol/Lの塩酸(HCl)を中和するには、NaOH溶液を何L使う必要があるか求めなさい。
【解答】
0.5L
【例題2】
0.1 mol/Lの酢酸(CH₃COOH)25 mLを中和するために、0.1 mol/Lの水酸化ナトリウム(NaOH)を用いた。必要なNaOHの体積を求めなさい。
25mL













