このページのまとめ
- 活性化エネルギーは、化学反応が進行するために必要な最小限のエネルギー。
- 活性化エネルギーが高いと反応が進みにくくなり、低いと反応が進みやすい。
- 触媒は、反応の活性化エネルギーを下げ、反応速度を速める役割を持つ。
- アレニウスの式を使って、活性化エネルギーを計算できる。
~先生と生徒の会話~
 生徒
生徒化学反応が起こるとき、ただ混ぜるだけでは反応が進まないことがありますよね。例えば、紙に火をつけるときも、最初にマッチを使わないと燃え始めないですよね。それって「活性化エネルギー」に関係しているんですか?



そうだね、その例はまさに活性化エネルギーの良い説明になるよ。「活性化エネルギー」とは、化学反応が進行するために必要な最小限のエネルギーのことなんだ。化学反応をイメージすると、分子同士がぶつかり合って反応を引き起こす必要があるんだけど、そのためには一定以上のエネルギーが必要になる。このエネルギーが「活性化エネルギー」なんだよ。



なるほど、分子が反応するためには、一定のエネルギーを与えないといけないんですね。だから紙を燃やすときも、最初に火をつけないと燃え始めないんですね。でも、どうして全ての反応にエネルギーが必要なんですか?



分子同士が反応するためには、まず結びつきを切り離して、新しい結びつきを作り出さなければならないからなんだよ。この「古い結びつきを壊す」ためにエネルギーが必要なんだ。例えば、紙を燃やすとき、セルロース分子の結合を切るために最初の熱が必要なんだよ。これが活性化エネルギーに相当するんだ。
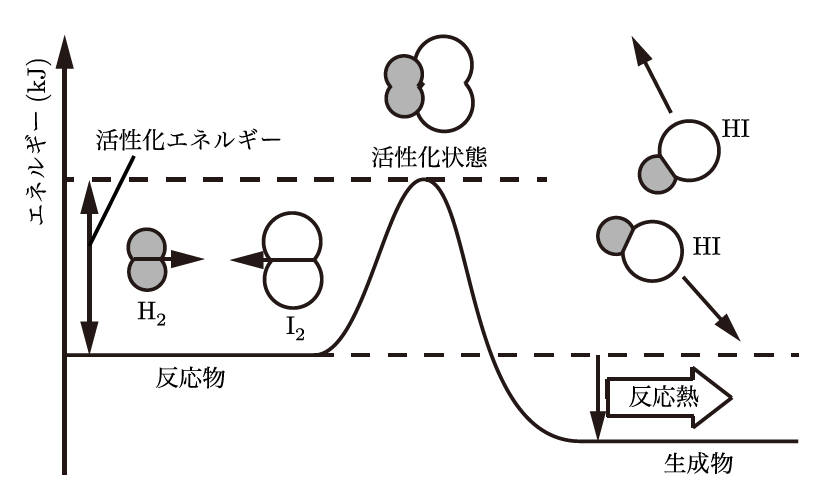




ああ、だから何かを始めるにはエネルギーが必要なんですね。じゃあ、活性化エネルギーが高い反応は、進みづらいってことですか?



その通り!活性化エネルギーが高いほど、反応が進むために必要なエネルギーも大きくなるから、反応が進みにくくなるんだ。逆に、活性化エネルギーが低い反応は、簡単に進むんだよ。例えば、酸素と水素を混ぜるだけではほとんど反応が起こらないけれど、火をつけると爆発的に反応が進むよね。それは、火が活性化エネルギーを与えることで、反応が一気に進むからなんだ。



じゃあ、触媒ってよく聞きますけど、これも活性化エネルギーに関係があるんですか?



そう!触媒は反応の活性化エネルギーを下げる役割を持っているんだ。触媒があると、反応が進むために必要なエネルギーのハードルが低くなるから、反応が速く、そして容易に進むようになるんだよ。例えば、車の排ガス処理に使われている触媒は、排ガス中の有害物質を分解する反応の活性化エネルギーを下げて、反応を効率的に進めるんだ。
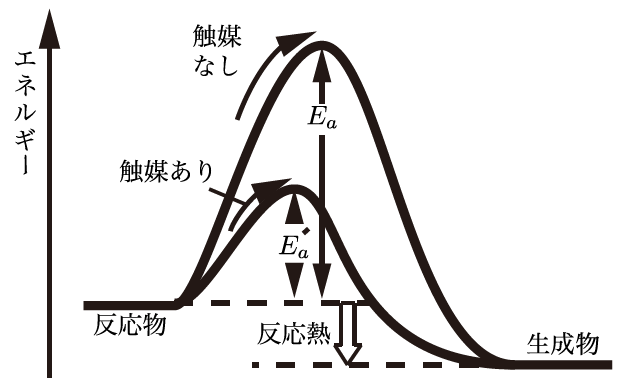




なるほど、触媒があると反応が進みやすくなる理由がわかりました!だから化学反応を加速させるのに触媒がよく使われるんですね。活性化エネルギーは具体的にどうやって計算するんですか?



活性化エネルギーは、実験で得られたデータを使って「アレニウスの式」というものを使って計算できるんだ。この式は、反応速度定数と温度との関係を示しているんだ。



数学的に表せるんですね!活性化エネルギーがどう影響するかが見えてきました。でも、具体的な実験ではどんなふうに測定するんですか?



実験では、異なる温度で反応速度を測定して、その結果を使ってアレニウスの式に当てはめて活性化エネルギーを算出するんだ。温度が上がると反応速度が速くなるから、それを比較して活性化エネルギーを求めることができるんだよ。
例題&解答
【例題1】ある化学反応の活性化エネルギーが100kJ/molである場合、この反応が進むためにはどれくらいのエネルギーが必要か、説明しなさい。
反応が進むためには、100kJ/molのエネルギーを分子に与える必要があります。このエネルギーを超えると、反応が進行する可能性が高まります。
【例題2】触媒を使うと、化学反応の活性化エネルギーがどのように変化するか説明しなさい。
触媒を使用すると、反応の活性化エネルギーが下がります。その結果、反応が進みやすくなり、反応速度が速くなります。













