このページのまとめ
- ファントホッフの法則は、浸透圧を計算するための式で、π=iCRTで表される。
- ファントホッフ因子は、溶質が溶液中でどのように振る舞うか、特に電解質の分解によって決まる。
- 浸透圧のつりあいは、溶液の内外で浸透圧が均等になったときに、溶媒の移動が止まる状態を指す。
~先生と生徒の会話~
 生徒
生徒浸透圧について前回学んだときに、「ファントホッフの法則」という言葉を聞いたんですが、これはどういう法則なんですか?浸透圧との関係が気になります。



いい質問だね!ファントホッフの法則は、浸透圧を計算するための基本的な法則なんだ。この法則を使えば、ある溶液の浸透圧がどれくらいかを簡単に計算できるんだよ。ファントホッフの法則は、理想気体の法則に似ていて、π=iCRTと表されるんだ。



ここで、πは浸透圧、iは溶質のファントホッフ因子、Cはモル濃度、Rは気体定数、そしてTは絶対温度だよ。この式を使うと、溶液中の溶質の量や温度が浸透圧にどう影響するかがわかるんだ。



なるほど、理想気体の法則みたいに、溶質の濃度や温度が浸透圧に影響するんですね。でも、「ファントホッフ因子」って何ですか?



ファントホッフ因子(i)は、溶質が溶液中でどのように振る舞うかを示すものなんだ。特に電解質の場合、溶質が水に溶けるときにどれだけのイオンに分解するかを表しているんだよ。例えば、NaCl(塩)は水に溶けるとNa⁺とCl⁻に分かれるから、ファントホッフ因子iは2になる。一方、砂糖のような非電解質は分解しないから、iは1になるんだ。



なるほど、溶けたときに何個の粒子になるかがファントホッフ因子なんですね。それで、浸透圧にどれくらいの影響があるかを決めるんですね。



その通り!だから、電解質の溶液は非電解質よりも浸透圧が高くなることが多いんだ。同じ濃度のNaClと砂糖水を比べると、NaClの方が浸透圧が高いんだよ。これが、ファントホッフ因子の違いによるものなんだ。



じゃあ、浸透圧のつりあいってどういうことですか?浸透圧がつりあう場面って、どんな状況なんでしょうか?



浸透圧のつりあいは、溶媒が半透膜を通じて移動するのが止まった状態を指すんだよ。これは、浸透圧が内外で均等になったときに起こるんだ。例えば、細胞が水に浸かっているとき、細胞の中と外で浸透圧が均等になると、水の出入りが止まって、細胞が安定した状態になる。これが浸透圧のつりあいだね。水銀とのつり合いを考えると、直接浸透圧の大きさを求めることもできるよ。

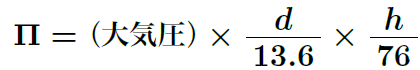



ここで、dは溶液の密度、hは液面差の高さを表しているよ。U字管を使えば、このような式で簡単に浸透圧を求められるね。



なるほど!U字管は浸透圧を求めるのに便利なんですね!それから、細胞の中と外で浸透圧が均等になると、細胞は膨らみも縮みもしないんですね。じゃあ、もし浸透圧が均等じゃないとどうなるんですか?



もし細胞の中と外で浸透圧が均等でないと、細胞は水を取り込んだり、逆に水を失ったりするんだよ。外側の溶液の浸透圧が高いと、細胞の中の水が外に出てしまって、細胞がしぼんでしまうことがあるし、逆に外の浸透圧が低いと細胞が水を取り込みすぎて膨らむこともあるんだ。これが、細胞にとって危険な状態になることもあるんだ。
例題&解答
【例題1】1モルのNaCl(ファントホッフ因子i=2)を1リットルの水に溶かした場合の浸透圧を、ファントホッフの法則を使って計算しなさい。温度は300K、気体定数Rは0.0821L·atm/mol·Kとする。
ファントホッフの法則に従って、
π=iCRT
π=2×1×0.0821×300=49.26atm
【例題2】浸透圧のつりあいが崩れた場合、細胞にどのような影響が出るか説明しなさい。
浸透圧のつりあいが崩れると、細胞内外の水の移動が活発になり、細胞は水分を失ってしぼんだり、逆に水を吸収しすぎて膨らんでしまうことがあります。これは細胞にとって危険な状態になる可能性があります。













