このページのまとめ
- 凝固点降下は、溶質を溶かすことで溶媒の凝固点が下がる現象。
- 溶質が溶媒の分子の結びつきを邪魔するため、より低い温度で凝固が起こる。
- 冷却曲線は、物質が冷える過程を表し、凝固点で温度が一時的に一定になる。
- 溶質があると、冷却曲線の凝固点が下がり、凍り始める温度が低くなる。
~先生と生徒の会話~
 生徒
生徒寒い日に道に塩を撒いているのを見かけたことがあるんですが、あれってどうして塩が役立つんですか?塩を撒くと、凍りにくくなるって聞いたんですが、それが「凝固点降下」に関係しているんですか?



そうだね、その現象はまさに「凝固点降下」と関係があるんだ。凝固点降下というのは、溶質を溶媒に溶かすと、その溶媒の凝固点(つまり凍る温度)が下がる現象のことだよ。だから、道に塩を撒くと、氷ができる温度がもっと低くなるんだ。



なるほど!水は通常0℃で凍るけど、塩を溶かすともっと低い温度でないと凍らなくなるんですね。どうしてそんなことが起こるんですか?



それは、溶質が溶けることで、溶媒の分子が規則正しく固まるのを邪魔するからなんだ。純粋な水では、分子が整然と並んで氷を作ることができるけど、そこに塩が加わると、水分子同士がうまく結びつけなくなる。その結果、凍るためにはより低い温度が必要になるんだ。これが「凝固点降下」だよ。



ああ、溶質が水の中で邪魔をするから、氷ができにくくなるんですね!じゃあ、他の溶質でも同じことが起こるんですか?



そうだね。砂糖やアルコールでも同じ現象が起こるよ。ただ、溶質によってその効果は違ってくるけど、基本的にはどんな溶質でも凝固点を下げることができるんだ。たとえば、車のウィンドウォッシャー液に使われているエチレングリコールも、凝固点降下の効果を利用しているんだよ。



それで、エンジンが凍らないようにするために使われているんですね!じゃあ、凝固点降下ってどうやって計算するんですか?



凝固点降下も、沸点上昇と同じように質量モル濃度に比例して起こるんだ。計算式はこうだよ:





ここで、ΔTは凝固点の降下、kfは溶媒の凝固点降下定数、mは質量モル濃度だよ。つまり、溶質の量が多いほど、凝固点が下がるんだ。



なるほど、モル濃度で計算するんですね!じゃあ、凝固点降下と関連して「冷却曲線」っていうのもあるって聞いたんですが、それは何ですか?



冷却曲線は、物質が冷える過程をグラフで表したものだよ。温度が時間とともにどのように変化するかを示しているんだ。たとえば、水を冷やしていくと、まず温度がどんどん下がるけど、0℃になるとしばらく温度が一定になる。この一定の時間が、水が氷になる過程、つまり凍っている間なんだ。凍り終わった後、また温度がさらに下がり続けるんだよ。



ああ、だから液体が凍り始めると温度がしばらく止まるんですね。面白い!じゃあ、凝固点降下が起こると、冷却曲線も変わるんですか?



その通り!溶質を溶かした溶液の冷却曲線は、純粋な溶媒と比べて凝固点が下がっているから、凍り始める温度が低くなるんだ。溶質が溶けている場合、凍るまでにもっと時間がかかることもあるし、凝固する過程も違う形で進むんだよ。
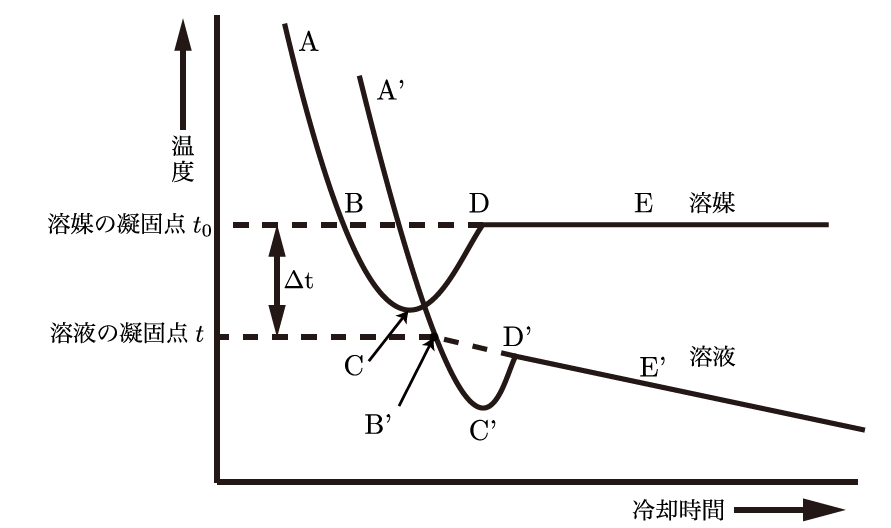




凝固点よりも低い温度になっている状態を過冷却と言うよ。冷却曲線でみるとわかりやすいから、よく覚えておこう。
例題&解答
【例題1】塩を水に溶かした場合、水の凝固点はどのように変わるか、凝固点降下の式を使って説明しなさい。
凝固点降下の式:ΔT=Kf⋅m
塩を溶かすと、凝固点降下定数Kfに比例して水の凝固点が下がり、0℃よりも低い温度で凍り始めます。
【例題2】純水と塩水を冷やした場合、冷却曲線にどのような違いが現れるか説明しなさい。
純水は0℃でしばらく温度が一定になり、その後氷に変わりますが、塩水は凝固点が低くなり、凍り始める温度が0℃よりも低くなります。また、凍る過程が異なり、冷却曲線もその影響を反映します。













