このページのまとめ
- 蒸気圧降下は、溶質を溶媒に溶かすことで、溶媒の蒸気圧が下がる現象。
- 沸点上昇は、蒸気圧降下によって溶液の沸点が高くなる現象。
- 蒸気圧降下と沸点上昇は、溶質のモル数に比例して変化し、溶液の濃度が高いほど大きくなる。
~先生と生徒の会話~
 生徒
生徒沸騰について前回の話でいろいろと学んだんですが、「蒸気圧降下」と「沸点上昇」という現象があると聞きました。これってどういうものなんですか?



蒸気圧降下と沸点上昇は、溶液の性質に関わる重要な現象なんだよ。まず「蒸気圧降下」について説明しようか。蒸気圧降下は、溶質を溶媒に溶かすことで、溶媒の蒸気圧が下がる現象なんだ。例えば、水に塩を溶かすと、その溶液の蒸気圧は純粋な水よりも低くなるんだよ。



蒸気圧って、前に学んだ液体が蒸発する際にその表面で発生する気体の圧力のことでしたよね?塩を溶かすとどうして蒸気圧が下がるんですか?



その通り、よく覚えてるね!蒸気圧が下がる理由は、溶質が溶媒の分子と混ざり合うことで、溶媒の分子が液体の表面に出てくるのを妨げるからなんだ。液体の分子が表面に出にくくなると、蒸発しにくくなるから、結果的に蒸気圧が低くなるんだよ。



ああ、なるほど。溶質が溶媒の表面を占めてしまうから、溶媒が蒸発しにくくなるんですね。でも、それが「沸点上昇」とはどう関係しているんですか?



いい質問だね!蒸気圧が低くなると、沸騰するために必要な条件も変わってくるんだ。沸騰というのは、液体の蒸気圧が外部の大気圧と同じになるときに起こる現象だったよね。だから、蒸気圧が低くなった分、沸騰させるためにはより高い温度にしなければならないんだ。この現象を「沸点上昇」と呼ぶんだ。



つまり、溶質を溶かすと蒸気圧が下がり、その結果、沸点が上がるんですね!例えば、塩水の方が真水より高い温度で沸騰するってことですか?



その通り!塩水の方が沸点が高いんだよ。実際、料理でも塩を入れると水の沸点が少し上がるから、沸騰までに時間がかかることがあるんだよ。この現象は、溶液に溶けている溶質の量に比例して大きくなるから、溶質が多いほど沸点も上昇するんだ。



それって、どうやって計算するんですか?



沸点上昇は、溶液の質量モル濃度に比例して変化するんだ。式はこう表せるよ:
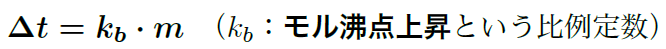
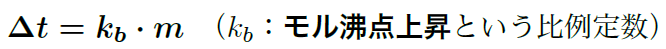



ここで、ΔTbは沸点の上昇、Kb は溶媒の沸点上昇定数、m は質量モル濃度だよ。つまり、溶質が多ければ多いほど、沸点は高くなるということなんだ。



なるほど!具体的に質量モル濃度と沸点上昇定数を使って計算するんですね。蒸気圧降下と沸点上昇って、実験や工業でもよく使われるんですか?



そうだね。例えば、蒸留や濃縮といった化学プロセスで蒸気圧降下や沸点上昇が重要な役割を果たすんだ。また、冷却システムや製薬工業でも、こうした性質を利用して効率的に作業を進めているんだよ。
例題&解答
【例題1】1モルの塩を1リットルの水に溶かしたとき、蒸気圧がどのように変化するか説明しなさい。
蒸気圧降下は溶質のモル数に比例する。したがって、1モルの塩が水に溶けると蒸気圧が低下し、蒸発しにくくなる。
【例題2】砂糖を水に溶かしたとき、沸点がどのくらい上昇するか、沸点上昇の式を使って説明しなさい。
沸点上昇の式:ΔTb=Kb⋅m
溶質の量が一定なら、沸点上昇は溶媒の定数Kbに比例して上昇する。