このページのまとめ
- 電気陰性度は、原子が共有結合において電子を引き寄せる力で、フッ素が最も高い。
- 極性分子は、電気陰性度の違いによって電荷の偏りが生じる分子で、水がその代表例。
- 非極性分子は、分子全体で電荷の偏りがない分子で、二酸化炭素がその代表例。
- 極性と非極性の違いは、日常の現象にも影響を与え、例えば油と水が混ざらない理由も極性の違いにある。
~先生と生徒の会話~
 先生
先生電気陰性度って聞いたことある?名前からしてちょっと難しそうだけど、実は化学でとても大事な概念なんだよ。



うーん、初めて聞きました。どういう意味なんですか?



簡単に言うと、電気陰性度は原子が電子を引きつける力のことだよ。例えば、共有結合で2つの原子が電子を共有しているとき、どちらかの原子がその電子を自分の方に引き寄せる力が強い場合があるんだ。これは、ちょうど綱引きをしているみたいな感じだね。どちらかが強ければ、ロープはその方向に引っ張られるでしょ?原子間でも似たことが起こっているんだよ。



なるほど、強い方が電子を自分の方に引き寄せるってことですね!どの原子が強いんですか?



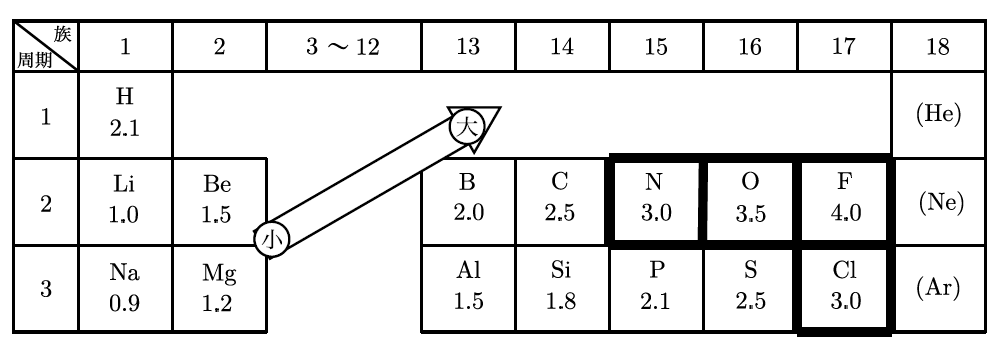
良い質問だね。フッ素(F)は、全ての元素の中で最も電気陰性度が高いんだ。つまり、フッ素は共有されている電子を強力に引きつけるんだ。この表を見てみよう。歯磨き粉にも含まれているフッ素が、こんな力を持っているなんて驚きだよね!



確かに、フッ素って意外に強いんですね。でも、他の原子はどうなんですか?



そうだね、原子によって電気陰性度の強さが違うんだ。例えば、水素(H)はフッ素ほど強くないし、炭素(C)もフッ素にはかなわない。つまり、フッ素と水素が結びついたときは、フッ素が強く引っ張るから、電子がフッ素側に引き寄せられるんだ。この違いが、分子の中で電荷の偏りを生み出すんだよ。




この電荷の偏りが「極性」ってことですか?



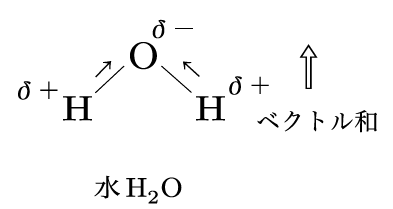
その通り!例えば、水(H₂O)は典型的な極性分子なんだ。水分子の中では、酸素が水素よりも電気陰性度が高いから、電子が酸素側に引き寄せられて、酸素が負の電荷を帯びるんだ。一方、水素側は正の電荷を持つことになる。この電荷の偏りが分子の極性なんだよ。実は、この極性があるから、水は他の物質を溶かしやすいんだ。砂糖を水に溶かすとすぐに溶けるでしょ?それは、水の極性が砂糖の分子を引き寄せるからなんだよ。




なるほど!だから水は色々なものを溶かせるんですね。でも、全ての分子が極性を持っているわけじゃないんですよね?



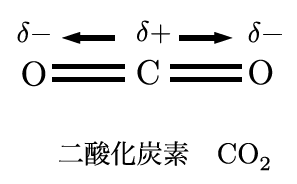
そうだね。例えば、二酸化炭素(CO₂)は酸素が炭素よりも電気陰性度が高いけど、分子の形が直線形だから、両端の酸素が同じ力で炭素から電子を引っ張る結果、全体としては電荷の偏りが生じないんだ。こういう分子は非極性分子と呼ばれるんだよ。

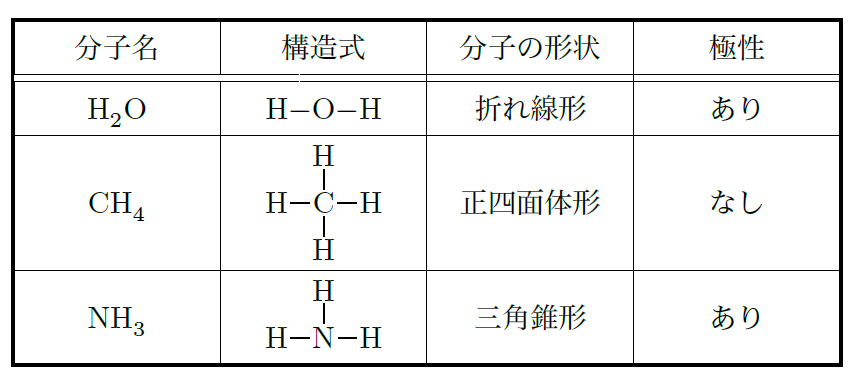




日常でも、極性と非極性の違いは色々なところで見ることができるんだ。例えば、油と水が混ざらないのは、水が極性分子で油が非極性分子だからなんだ。水と油はお互い引き合わないから分離しちゃうんだよ。サラダドレッシングを作るとき、油と酢がすぐに分かれるのも同じ理由だよ。



へぇ、身近なところでもそんな化学が関わっているんですね!面白いです。



そうなんだ。分子の極性や電気陰性度を知ると、もっと色々な現象が理解できるようになるよ。もっと他の物質についても見てみよう!
例題&解答
【例題1】次の分子のうち、極性分子はどれですか?
・二酸化炭素(CO₂)
・水(H₂O)
・メタン(CH₄)
水(H₂O)
【例題2】電気陰性度が高い原子が分子の極性にどう影響するか説明しなさい。
電気陰性度が高い原子は、共有結合で電子を強く引き寄せるため、分子内で電子の偏りが生じ、分子の中で電荷の不均一な分布ができることで極性が生まれる。













