ページのまとめ(所要時間:6分)
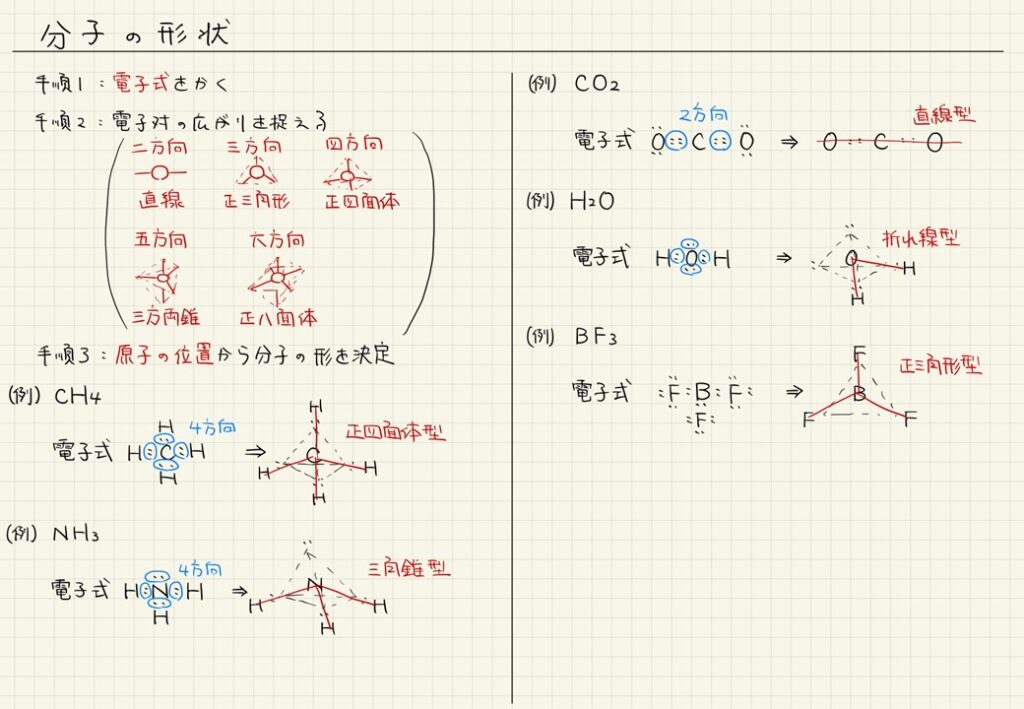
学習のポイント
- 分子の形状は、電子式、電子対の広がり、原子の位置を考慮して決定する。
- 分子の形状は、VSEPR理論を用いて、電子対ができるだけ遠く離れるように決定される。
- 水分子は「曲がった形」、二酸化炭素は「直線形」、メタンは「正四面体形」をしている。
まとめノート
~先生と生徒の会話~
 先生
先生今日は「分子の形状」について話そうか。分子って形があるって知ってた?



形があるんですか?なんとなく丸いイメージがあったんですが…。



実は分子にはいろいろな形があって、それが物質の性質に大きな影響を与えているんだよ。例えば、水分子(H₂O)は「曲がった形」をしているし、二酸化炭素(CO₂)は「直線形」なんだ。この形は、原子同士の結びつきと電子の広がり方によって決まるんだよ。



どうやってその形が決まるんですか?



その手順には3つのステップがあるんだ。まず、手順1は「電子式を書くこと」だよ。これは、原子同士がどのように電子を共有しているかを示す図なんだ。
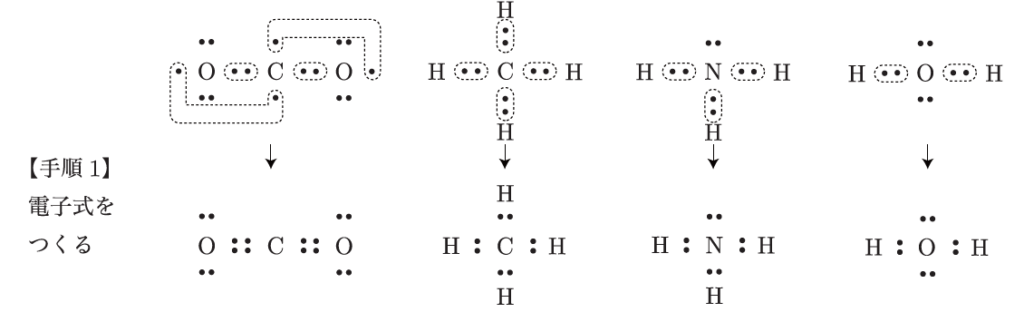




電子式って、どうやって書けばいいんですか?



例えば、水分子の場合、酸素が中心にあって、2つの水素と共有結合を作っている。この電子式を書いたら、次に手順2として、「電子対の広がりを考える」。このとき、結合している電子だけじゃなくて、孤立している電子対も含めて考えるんだ。電子同士は互いに反発するから、できるだけ遠くに離れようとするんだ。
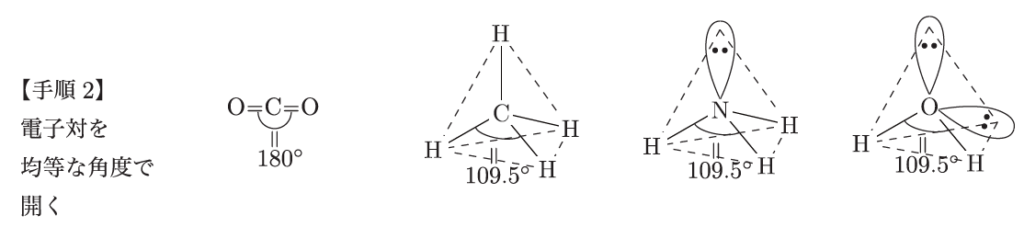




なるほど。電子対が反発し合うんですね。じゃあ、最後の手順は?



最後の手順3は「原子の位置を確認する」ことだよ。このとき、結合している原子だけを見て形を決めるんだ。例えば、水分子では、酸素に2つの水素が結合しているけど、孤立した電子対もあるから、全体の形は「曲がった形」になるんだ。これがVSEPR理論の基本的な考え方なんだよ。





結合の種類によって形も変わるんですか?



その通り!単結合、二重結合、三重結合があって、それぞれ電子対の数や結合の強さが違う。例えば、単結合は1組の電子対を共有し、メタン(CH₄)がその例。二重結合は2組の電子対を共有し、二酸化炭素がそうだね。三重結合は3組の電子対を共有し、窒素分子(N₂)がその例だよ。二重結合や三重結合は一方向としてカウントすることを覚えておこう。
例題&解答
【例題1】
次の分子の形状はどれですか?
(1) 二酸化炭素(CO₂)
(2) メタン(CH₄)
(3) 水(H₂O)
【解答】
(1) 直線形
(2) 正四面体形
(3) 曲がった形
【例題2】
VSEPR理論を使って、分子の形状を予測する手順を説明しなさい。
【解答】
電子式を書く:分子の電子配置を示す。
電子対の広がりを考える:電子同士の反発を最小化するように配置を決める。
原子の位置を確認する:結合している原子のみを見て、分子の形を決定する。













