ページのまとめ(所要時間:8分)
学習のポイント
- 共有結合は、原子が電子を共有して結びつく結合で、特に非金属元素同士でよく見られる。
- 共有結合結晶は、原子が三次元的に共有結合で繋がった結晶構造を持ち、代表的なものにはダイヤモンド、黒鉛、ケイ素(Si)、二酸化ケイ素(SiO₂)がある。
- ダイヤモンドは非常に硬く、融点が高い。
- 黒鉛は層状の構造を持ち、滑りやすく、電気を通す性質を持つ。
- ケイ素や二酸化ケイ素も共有結合結晶で、電子機器や光ファイバーに使われている。
まとめノート
~先生と生徒の会話~
 先生
先生今日は「共有結合」と「共有結合結晶」について詳しく話してみようか。共有結合って聞いたことある?



うーん、聞いたことはあるけど、イオン結合とかとどう違うのかよくわかりません。



いい質問だね!共有結合は、原子同士が電子を共有することで結びつく結合のことなんだ。例えば、水(H₂O)の中では、酸素と水素がそれぞれ電子を共有して結びついているんだよ。これによって、両方の原子が安定した電子配置を持てるんだ。



なるほど!電子をやりとりするんじゃなくて、共有するんですね。



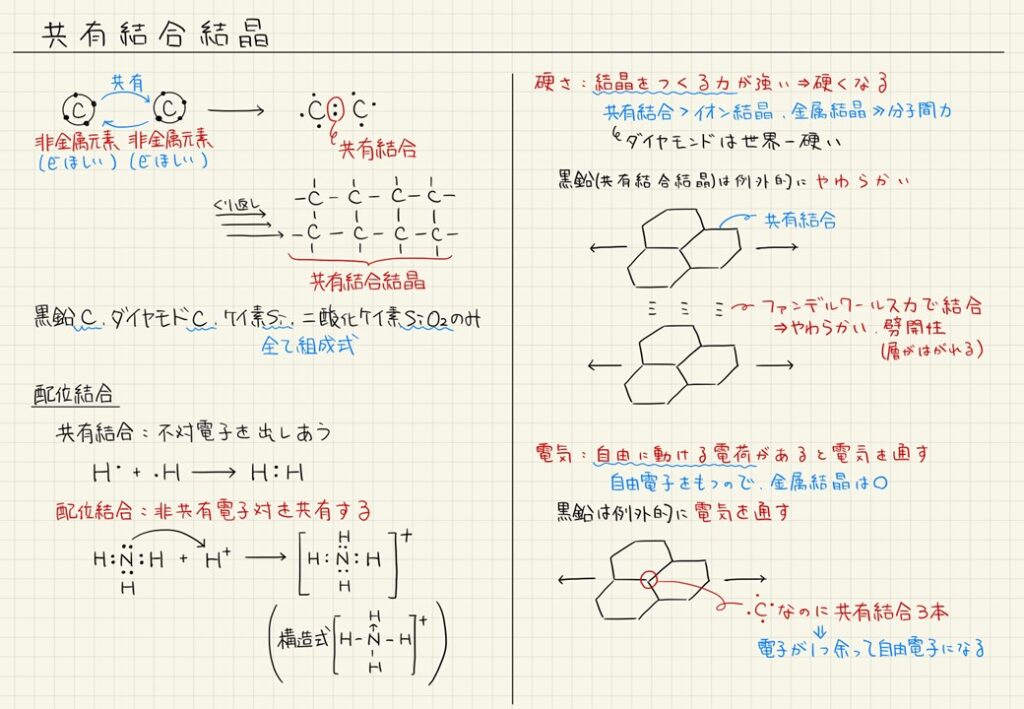
その通り。イオン結合とは異なり、共有結合では電子を「譲る」わけじゃなくて、一緒に使っているんだ。そして、この結合は非金属元素同士でよく見られるんだ。例えば、水素分子(H₂)や酸素分子(O₂)も共有結合で成り立っているよ。この図を見てみよう。




じゃあ、共有結合結晶って何ですか?



それが今日のもう一つのポイント、共有結合結晶だね。共有結合結晶は、原子が三次元的に規則正しく共有結合で繋がっている結晶のことなんだ。代表的な例には、ダイヤモンド、黒鉛、ケイ素(Si)、二酸化ケイ素(SiO₂)があるんだよ。



ダイヤモンドって共有結合結晶なんですね!硬いから特別だと思ってました。



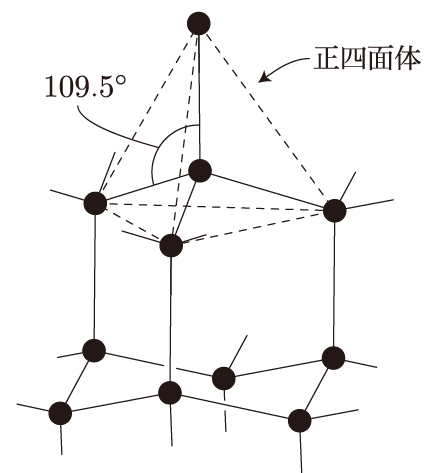
そうなんだ。ダイヤモンドでは、各炭素原子が他の4つの炭素原子と強力に共有結合していて、これが非常に硬い構造を作っているんだよ。また、融点も非常に高くて、4000℃近くになるんだ。これがダイヤモンドの結晶構造だよ。




それはすごいですね!じゃあ、黒鉛も同じ炭素なのに、なんで柔らかいんですか?



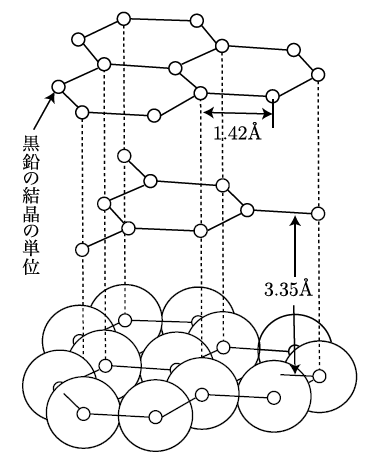
いい質問だね。黒鉛は、炭素原子が平面状に共有結合していて、その平面同士の間は弱い力で結びついているんだ。だから、層状の構造が簡単に滑りやすく、柔らかいんだよ。これが黒鉛の持つ滑りやすさや電気を通す性質の理由なんだ。黒鉛の構造も見てみよう。




なるほど、同じ炭素でも結合の仕方で全然違うんですね。じゃあ、ケイ素と二酸化ケイ素も同じですか?



その通り!ケイ素(Si)も、ダイヤモンドと同じように三次元的な共有結合構造を持っているんだ。さらに、二酸化ケイ素(SiO₂)、つまり石英も同じような結晶構造を持っていて、これらはガラスや光ファイバーに使われているんだよ。
例題&解答
【例題1】
次の物質のうち、共有結合結晶であるものを全て選びなさい。
・ダイヤモンド
・塩化ナトリウム(NaCl)
・黒鉛
・ケイ素(Si)
・鉄(Fe)
・二酸化ケイ素(SiO₂)
【解答】
- ダイヤモンド
- 黒鉛
- ケイ素(Si)
- 二酸化ケイ素(SiO₂)
【例題2】
黒鉛とダイヤモンドがどちらも炭素でできているのに、物理的性質が異なる理由を説明しなさい。
【解答】
黒鉛は平面状に共有結合が形成され、その層同士が弱い力で結びついているため、柔らかく滑りやすい。一方、ダイヤモンドは炭素原子が三次元的に共有結合しているため、非常に硬くなっている。













