このページのまとめ
学習のポイント
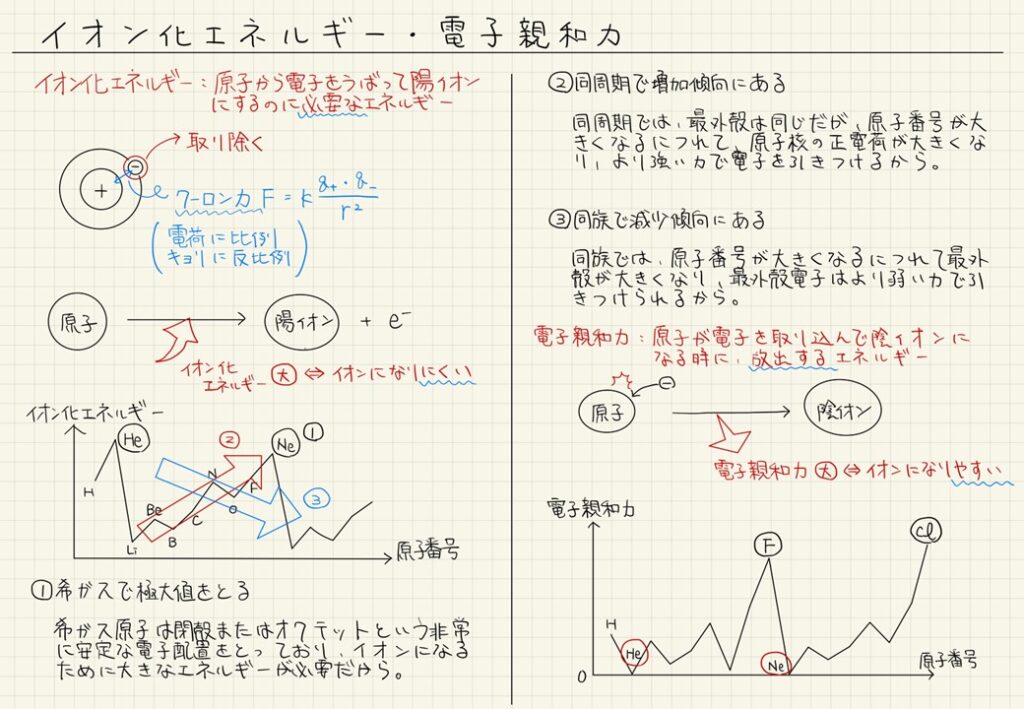
- イオン化エネルギーは、原子から電子を取り除くために必要なエネルギーであり、同周期では陽子の数が増えて電子を強く引きつけるため大きくなり、同族では電子が核から遠ざかるため小さくなる。
- 希ガスはすでに安定しているため、イオン化エネルギーが極めて大きい。
- 電子親和力は、原子が電子を受け取るときに放出されるエネルギーで、非金属は大きく、希ガスはほとんどない。
まとめノート
~先生と生徒の会話~
 先生
先生今日は「イオン化エネルギー」と「電子親和力」について詳しく話してみようか。原子がどのようにして電子を扱うかを理解するには、この2つがとても重要なんだ。



イオン化エネルギーって、なんだか難しそうですね。何を意味するんですか?



イオン化エネルギーとは、原子から電子を取り除くために必要なエネルギーのことだよ。たとえば、ナトリウム原子から1つの電子を取り除いてナトリウムイオンにするには、エネルギーが必要だよね。それがイオン化エネルギーなんだ。



なるほど、じゃあ、どうしてエネルギーが必要なんですか?



電子は原子核に引きつけられているから、外すにはエネルギーを使って引き剥がす必要があるんだ。しかも、このエネルギーの大きさは原子の構造や電子の配置によって変わるんだよ。



じゃあ、イオン化エネルギーは周期表のどこで大きくなるんですか?



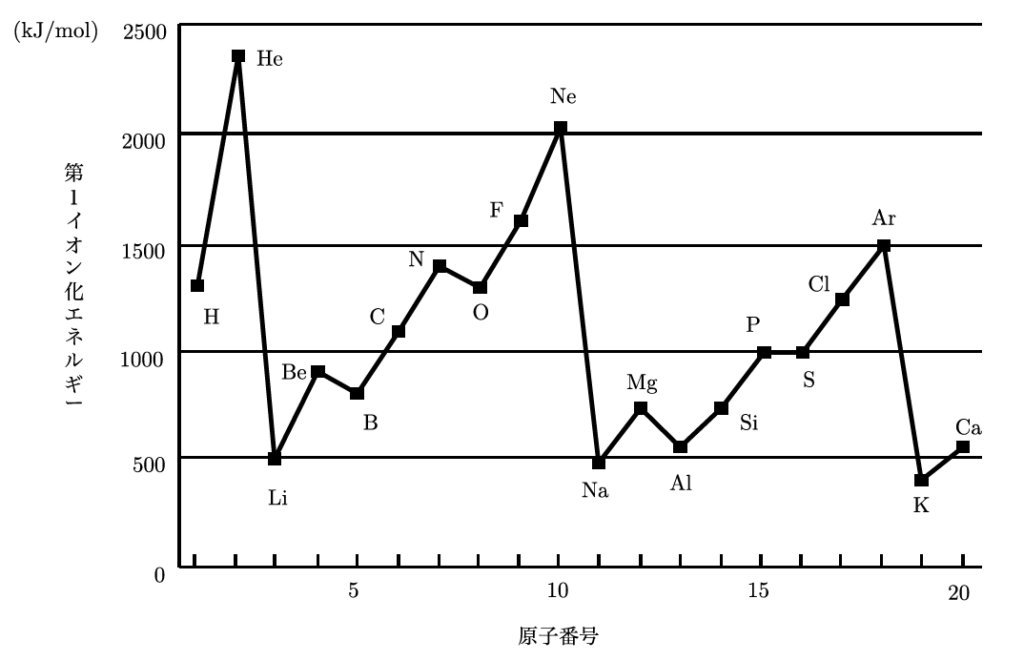
これが面白いところで、まず同じ周期で見ると、左から右に進むにつれてイオン化エネルギーは大きくなるんだ。なぜなら、原子の中心にある陽子の数が増えて、電子を強く引きつける力が大きくなるからなんだよ。そのため、電子を外すのがどんどん難しくなっていくんだ。



逆に、同じ族ではどうなんですか?



同じ族で見ると、上から下に進むにつれてイオン化エネルギーは小さくなるんだ。なぜなら、原子が大きくなって、電子が核から遠ざかるから、引きつける力が弱くなるんだ。だから、電子を取り除くのが比較的簡単になるんだ。



じゃあ、希ガスはどうなるんですか?



希ガスは、最外殻がすでに満たされていて、安定しているよね。そのため、電子を失うことを非常に嫌うんだ。その結果、希ガスのイオン化エネルギーが極めて大きくなっているんだよ。これらをまとめて、グラフで見てみよう。




なるほど。じゃあ、電子親和力って何ですか?



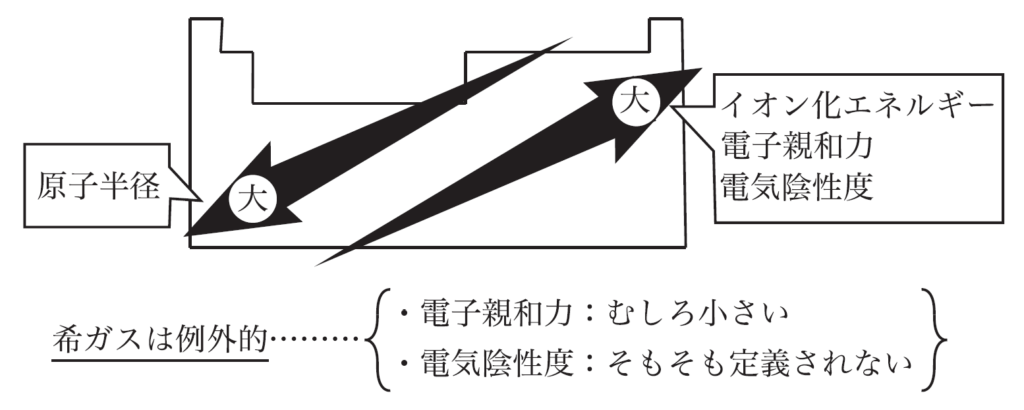
電子親和力は、原子が電子を受け取るときに放出されるエネルギーのことだよ。塩素や酸素のような非金属は、電子を受け取ることで安定するため、大きな電子親和力を持っているんだ。反対に、希ガスは最外殻が満たされているから、電子を受け取ってもあまり安定にはならない。つまり、希ガスの電子親和力はほとんどないんだ。イオン化エネルギーや電子親和力、原子半径の推移を元素周期表上でみると、次の図のようになるよ。

例題&解答
【例題1】
次の元素のうち、イオン化エネルギーが最も高いのはどれですか?
・ナトリウム、アルゴン、酸素
【解答】
アルゴン
【例題2】
次の元素のうち、電子親和力が最も大きいのはどれですか?
・フッ素、リチウム、ネオン
【解答】
フッ素