このページのまとめ
学習のポイント
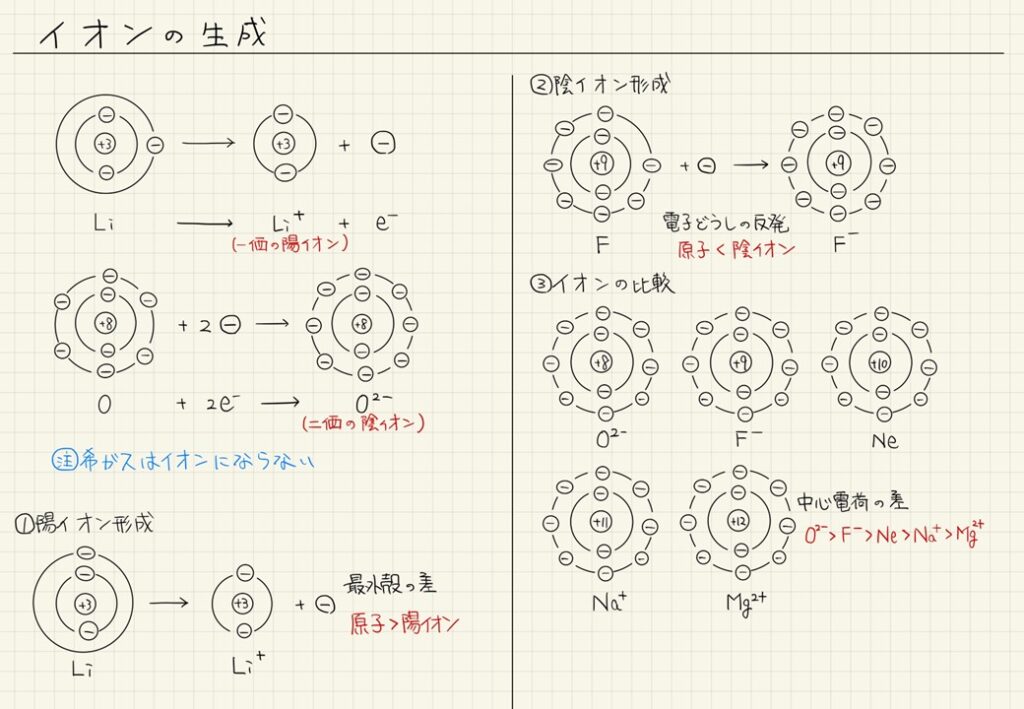
- イオンは、原子が電子を失ったり得たりして電荷を持つ状態のこと。
- 陽イオンは電子を失って正の電荷を持ち、陰イオンは電子を受け取って負の電荷を持つ。
- イオンは希ガスと同じ電子配置を目指して電子をやりとりし、安定した構造をとる。
- 原子から陽イオンになると、最外殻が一つ内側になり、半径が小さくなる。
- 陰イオンは電子を受け取ることで、半径が大きくなる。
- イオン同士は静電気的な引力で引き合い、化合物を形成する。
まとめノート
~先生と生徒の会話~
 先生
先生今日は「イオン」について話してみようと思うんだ。まず、身の回りにどんな物質があるか、ちょっと考えてみて。



えーと、ペンとか水とか、あとこの机も物質ですよね。



そうだね。それらの物質は、全部原子からできているんだ。でも、実際には私たちが触れている多くの物質は、ただの原子じゃなくて、イオンという形で存在していることが多いんだよ。



イオンって、普通の原子とは違うんですか?



うん、少し違うんだ。イオンっていうのは、原子が電子を失ったり得たりして、電荷を持った状態のことを言うんだ。通常、原子は陽子と電子の数が等しいから電気的には中性なんだけど、電子を失うと正の電荷を持つようになり、逆に電子を受け取ると負の電荷を持つんだよ。





どうしてそんなふうに電子の数が変わるんですか?



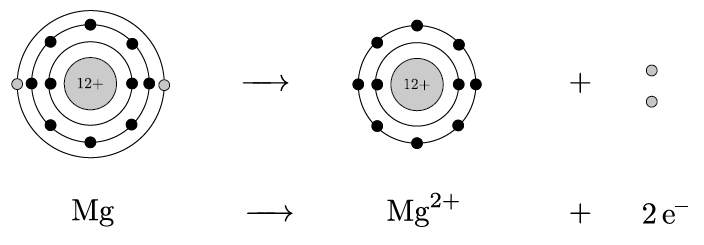
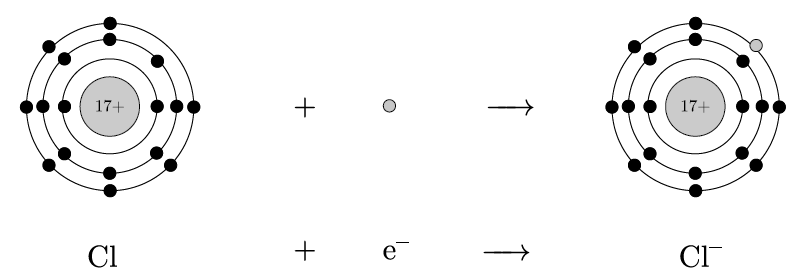
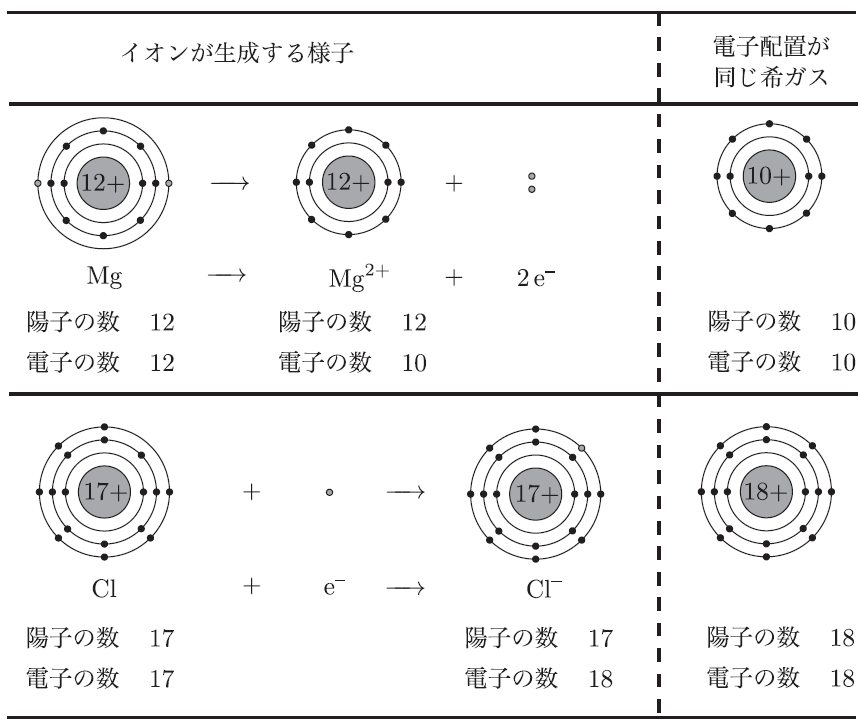
多くの原子は、希ガスと同じ安定した電子配置を目指して、電子をやり取りするんだ。たとえば、ナトリウム Mg は2個の電子を失って、最外殻が満たされ、ネオンと同じ電子配置を持つようになるんだ。これでナトリウムは陽イオンになるんだよ。一方、塩素 Cl は1個の電子を得て、アルゴンと同じ電子配置になり、陰イオンになるんだ。




へえ、安定するために電子をやりとりしてイオンになるんですね。



その通り!ナトリウムが電子を失うと陽イオン Mg2+ になり、塩素は電子を受け取って陰イオン Cl− になるんだ。この2つのイオンは、静電気的な引力で強く引き合い、塩化マグネシウムという化合物をつくるよ。



そうやって化合物ができるんですね!でも、原子とイオンって、大きさが変わるんですか?



うん、これも大事なポイントだね。原子から陽イオンになると、電子を失うことで最外殻が一つ内側の殻になるから、半径が小さくなるんだ。一方で、陰イオンは電子を受け取ることで電子同士が反発し合い、半径が大きくなるんだよ。



なるほど、イオンになると大きさも変わるんですね。陽イオンは小さく、陰イオンは大きくなるんだ。



その通り!それから、同じ電子配置をとるイオンについても大きさを比べてみよう。例えば、O2-、F–、Ne、Na+、Mg2+は全てネオンの電子配置をとるよ。しかし、中心電荷が大きい方が強く中心に引き付けるので、Mg2+が最も小さく、O2-が最も大きなイオンとなるよ。
例題&解答
【例題1】
ナトリウム原子が1個の電子を失うと、何イオンになりますか?
【解答】
ナトリウムイオン(Na+)、陽イオン。
【例題2】
次のイオンのうち、陰イオンはどれですか?
Na+、Cl−、Ca2+、NH4+
【解答】
Cl−(塩化物イオン)。













