このページのまとめ
学習のポイント
- 物質は温度や圧力の変化によって固体・液体・気体と状態変化をおこす。
- 状態図では、多くの物質とH2Oとで融解曲線の傾きが異なる。
- 気液平衡とは、蒸発と凝縮のスピードが等しくなって、見かけ上変化がなくなった状態のこと。
- 気液平衡のときの気体の圧力を飽和蒸気圧と呼ぶ。
- 飽和蒸気圧は温度に依存し、大気圧と飽和蒸気圧が等しくなる温度が沸点である。
まとめノート
このページでは,物質の三態について解説していきます。物質は,温度や圧力によって固体・液体・気体に状態変化をします。一般には加圧することで気体から液体,液体から固体へと変化しますが,水は少し例外的な挙動を示します。また,気体と液体が共存している状態を気液平衡と呼びます。このページの後半では,気液平衡について解説をしていきます。
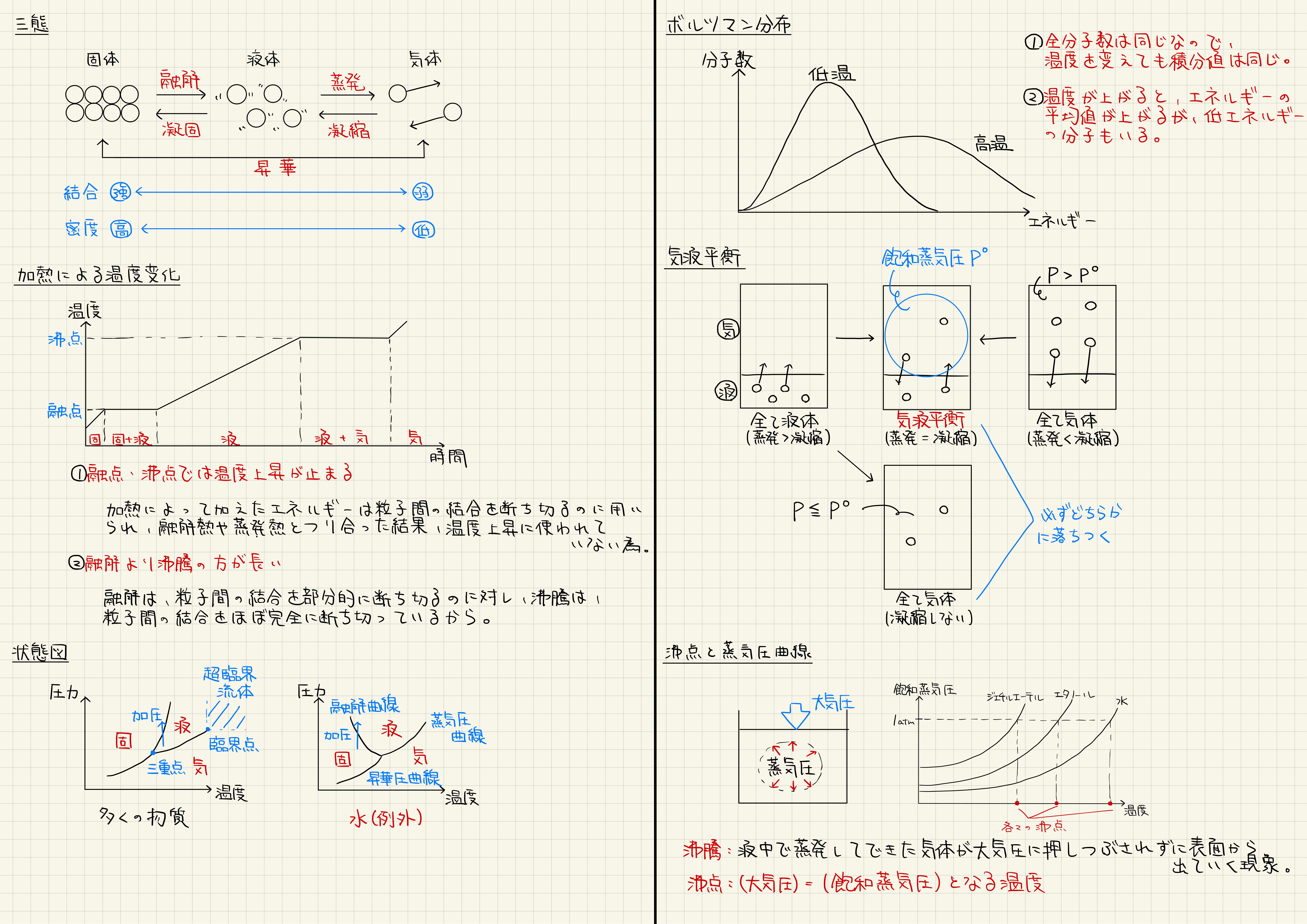
物質の三態
物質は,固体・液体・気体いずれかの状態をとります。固体から液体になることを融解,液体から気体になることを蒸発と呼びます。逆に,気体から液体になりことを凝縮,液体から固体になることを凝固と呼びます。固体から直接気体になることは昇華,気体から固体になることも昇華(凝華とも言う)と言います。
固体から液体,気体になるにつれて結合が弱くなり,密度が低くなっています。これは,加熱することで状態変化の際に粒子間の結合が切断されるからです。
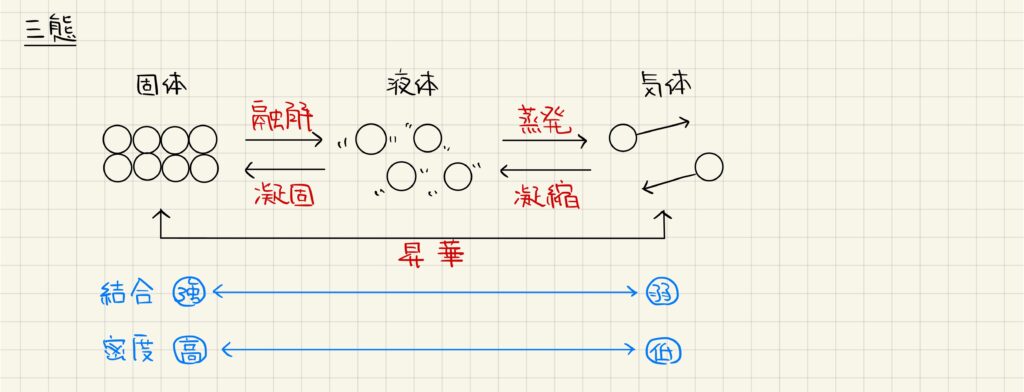
加熱による温度変化のグラフ
固体状態から加熱した際の温度変化のグラフがよく出題されます。固体状態で徐々に温度が上昇し,融解が始まる融点で一度温度上昇が止まります。その後液体だけの状態で温度が上昇していき,沸点に達するとまた温度上昇が止まります。最後に全て気体になるとまた温度が上昇していきます。
このグラフの中で,融点・沸点では加熱しているのにも関わらず温度上昇が停止しています。これは,加熱によって加えてエネルギーが全て状態変化に使われており,融解熱や蒸発熱とつり合っているからです。
また,融解よりも蒸発の方が大きなエネルギーを要します。これは,融解は結合を一部切断すれば良いのに対して,蒸発では粒子間の結合をほぼ全て切断しなければならないからです。
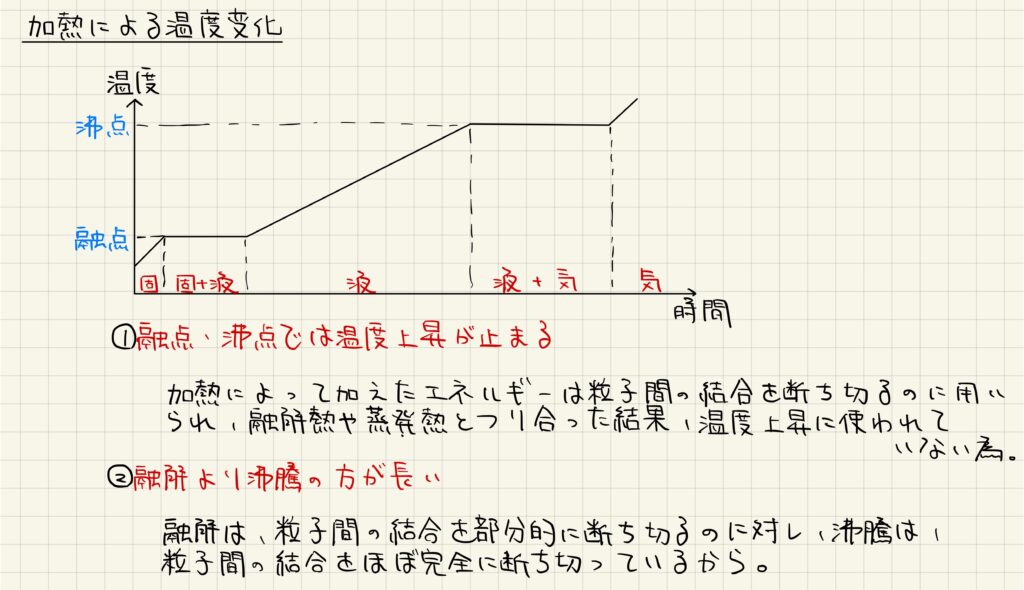
状態図
物質の状態変化は,温度と圧力の変化によって生じます。温度と圧力から,それぞれの物質がどのような状態にあるのかを示した図を状態図と言います。多くの物質は上図左のような状態図を描き,加圧することで気体から液体,液体から固体へと変化していきます。
しかし,水に関しては融解曲線が負の傾きをとっており,例外的な挙動を示しています。このため,氷の結晶を加圧すると液体の水に変化します。これは,氷の結晶が水素結合により隙間の多い構造をとっており,液体の水よりも密度が低いことに起因しています。
ボルツマン分布
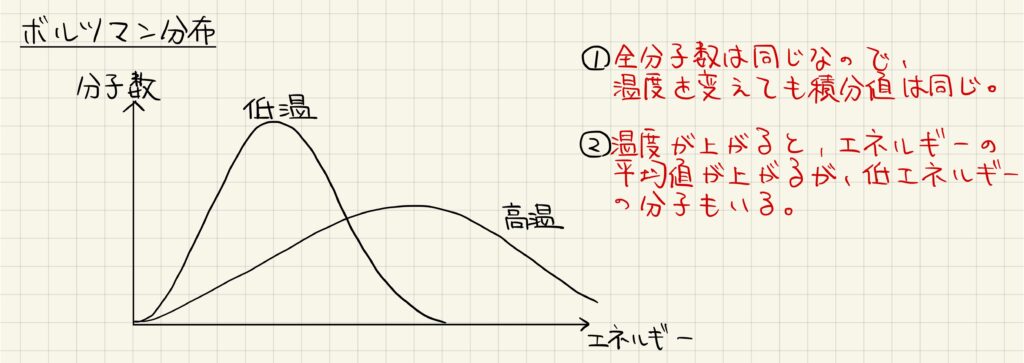
この後の気液平衡を理解するために,ボルツマン分布に関して学習しておきましょう。上図は,様々なエネルギーを持つ分子が異なる数存在していることを表しています。
低音のグラフに比べて,高温のグラフでは,山が右下に移動していることが分かります。しかし,全分子数は同じなので,温度を変えても積分値は同じになります。
温度が上がるとエネルギーの平均値が上がるが,いずれの温度でも低エネルギーな分子が一定数存在していることを確認しておきましょう。
気液平衡
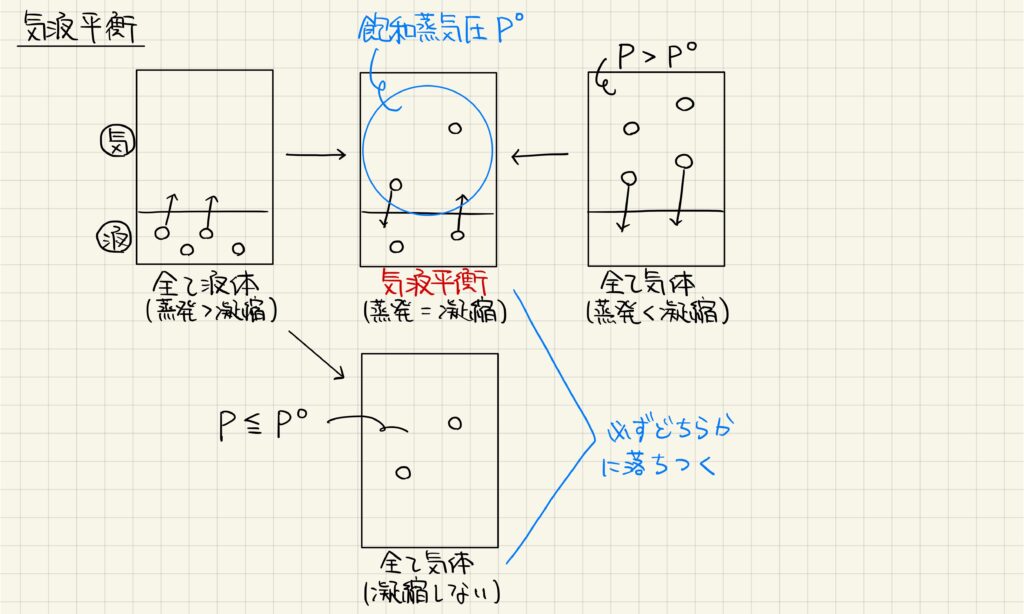
密閉した容器に揮発性の液体を加えると,エネルギーが高い一部が蒸発して,気体が生じます。気体分子の中でエネルギーが低いものは逆に凝縮して,液体に戻ります。これらの状態変化が同時に起こり,蒸発と凝縮のスピードが等しくなると,見かけ上は変化がない状態になり,気液平衡の状態になります。気液平衡の時の気体の圧力を飽和蒸気圧と呼びます。
ただし,分子数が少ないと,全てが気体になった状態で安定する場合があります。以上より,密閉容器では,気液平衡または全て気体の状態で落ち着くことになります。
沸点・蒸気圧曲線
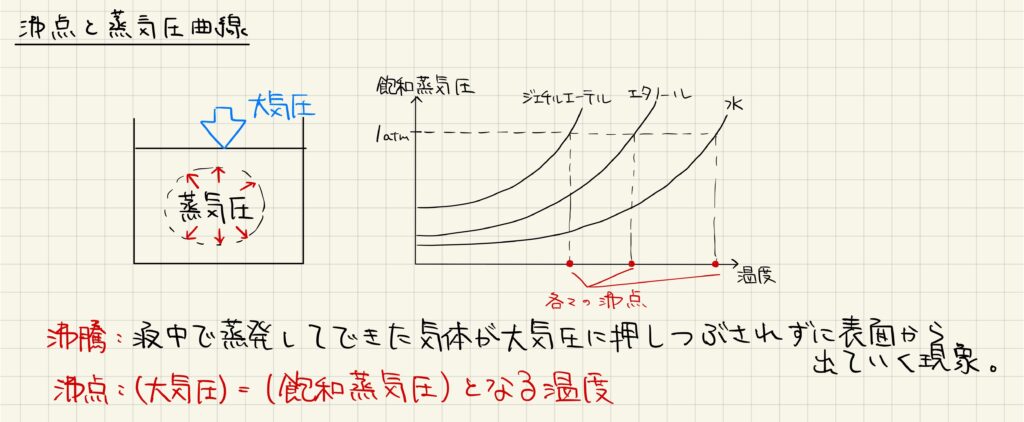
沸騰とは,液体の中で蒸発してできた気泡が大気圧に押しつぶされずに液面から出て行く現象を指します。液体中の気泡は飽和蒸気圧を持っていますが,この飽和蒸気圧は温度に依存して変化します。温度と飽和蒸気圧の関係を表したグラフを蒸気圧曲線と呼びます。以上より,大気圧と飽和蒸気圧が等しくなる温度が沸点です。













