このページのまとめ
学習のポイント
- アボガドロ定数を1molとして定義し、原子量とモル質量の値が等しくなる。
- 気体は種類によらず、標準状態において22.4L/molとなる。
- 化学反応式は左辺に反応物、右辺に生成物を書き、両辺を→で結ぶ。
- 化学反応式では、両辺の原子数が等しくなるように係数をつける。
まとめノート

このページでは,物質量の定義や化学反応式の立て方について解説します。化学の計算においては,物質量の概念を理解することが非常に重要です。物質量の単位はモルで表し,原子が何個反応しているかを表現することができます。化学反応式と組み合わせて,反応物がどれだけ反応し,生成物がどれだけ生成したのか求めていきましょう。
物質量
物質量の定義

質量数が12の炭素原子は,1つで1.993×10-23gという重さを持っています。しかし,この数値は非常に小さく,イメージもしづらいです。したがって,質量数が12の炭素原子の重さを12と決めて,他の原子の重さについても相対質量で考えることにしています。
では,質量数12の炭素原子を多数集めて,きっちり12gにした場合を考えましょう。この時,炭素原子は6.02×1023個集まっています。この数字をアボガドロ定数と言いますが,これも数字が大きすぎて扱いづらいです。したがって,このアボガドロ定数6.02×1023個を1molと定義して,計算に用いていきます。この考え方は,鉛筆12本を1ダースと捉えるのと同じです。
モル質量
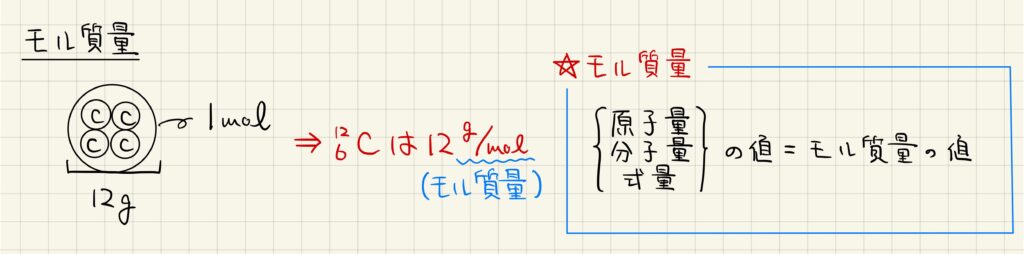
つまり,質量数12の炭素原子を1mol集めると,12gになることが分かります。以上をまとめると,質量数12の炭素原子は12g/molと表されます。この単位をモル質量と呼びます。原子の相対質量から求まる原子量,分子量,式量には単位がありませんが,実質的にはモル質量と値が同じになります。
気体の物質量

気体状態の物質では,気体の種類によらず,標準状態(0℃,1atm)において22.4L/molとなります。これは,全ての気体に関して成立する状態方程式から求めることができます。状態方程式にしたがって計算すると,1molあたりの気体の体積は必ず22.4Lになります。状態方程式については,気体のページで詳しく解説しています。
化学反応式
化学反応式の立て方

化学反応式では,左辺と右辺の間を矢印で結びます。左辺には反応前の物質(反応物),右辺には反応後の物質(生成物)を置きます。左辺,右辺それぞれに意味があるので,数学における方程式のように移項することはできません。

化学反応とは,原子の組み替えです。したがって,反応の前後で原子の個数が増減してはいけません。つまり,反応物と生成物を比較した時に,それぞれの原子の数が等しくなっている必要があります。この条件を満たすために,各物質に係数をつけます。
係数の付け方

化学反応式の係数を決める方法として,目算法というものがあります。ブタンが燃焼して二酸化炭素と水になる反応を例にとってみましょう。仮にブタンの係数を1とおくと,両辺で原子数が等しくなるように,酸素の係数が13/2,二酸化炭素の係数が4,水の係数が5となります。化学反応式の係数は最も簡単な整数比でなければならないので,両辺を2倍して,正しい化学反応式が得られます。

係数を確実に求められる方法として,未定係数法があります。これは,全ての係数を未知数として置き,各原子に関して両辺で数が等しくなるように方程式を立て,その連立方程式を解くというものです。連立方程式を解くのにやや時間がかかりますが,必ず係数を求めることができます。
化学反応式の量的関係
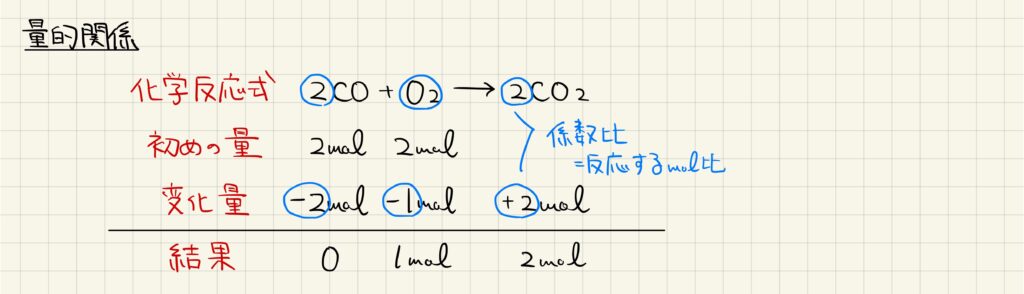
ここまで学習した物質量の概念と化学反応式の立て方を組み合わせて,化学反応の量的関係を計算することができます。量的関係とは,どれだけ化学反応が進行したかを表します。
化学反応式の係数比は,そのまま反応する物質量比として扱うことができます。例えば一酸化炭素が燃焼して二酸化炭素になる反応において,一酸化炭素と酸素が2molずつ存在している場合を考えましょう。一酸化炭素が2mol反応して無くなった時,酸素は係数比2:1より1mol反応して残り1molとなっています。また,二酸化炭素は2mol生じています。このように,表を書いて物質量を整理することで化学反応の量的関係を考えることができます。













