このページのまとめ
学習のポイント
- 共有結合には、共有する不対電子の数で単結合・二重結合・三重結合に分類される。
- 電気陰性度とは、原子が共有電子対を引き付ける強さの指標であり、水素で最も小さく、フッ素や酸素・窒素で大きな値をとる。
- 分子の形は電子対の広がりから検討でき、電気陰性度の差から分子全体の極性の有無を判断できる。
まとめノート

このページでは,分子の表し方や電気陰性度,分子の形や極性について解説していきます。非金属の原子が結合する時,共有結合を作ります。共有結合によってできる分子は様々な性質を示し,それらを理解するためには電気陰性度が非常に重要となります。電気陰性度から分子の極性の決め方まで,順番に見ていきましょう。
分子の表し方
結合の分類
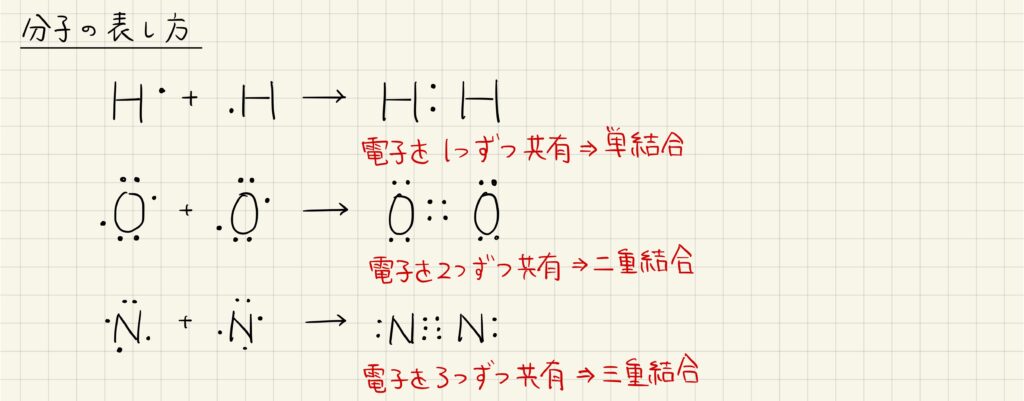
非金属の原子どうしが結合するとき,共有結合を形成します。共有結合は互いの不対電子を共有するのですが,その数によって共有結合に種類があります。不対電子を1つずつ共有する場合は単結合,2つずつ共有する場合は二重結合,3つずつ共有する場合は三重結合と呼びます。
分子式・電子式・構造式
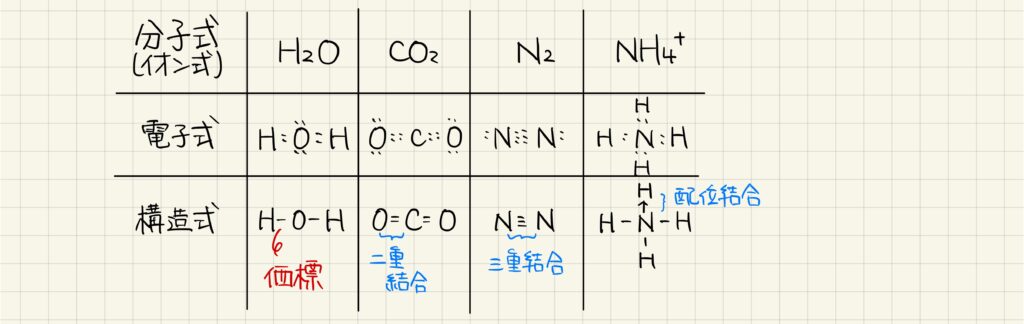
分子の表し方は,分子式・電子式・構造式など様々です。分子式とは,分子中の原子の個数を表す式ですから,例えばH2Oには水素原子が2つと酸素原子が1つ含まれていることがわかります。
電子式とは,電子の様子を・で表したものです。共有結合によってそれぞれの原子の周りに8個の電子が存在するようになります。二重結合や三重結合の表し方を確認しておきましょう。
構造式とは,結合の様子を価標で表したものです。二重結合,三重結合の表し方だけではなく,配位結合の表記も確認しておきましょう。
電気陰性度
電気陰性度の定義
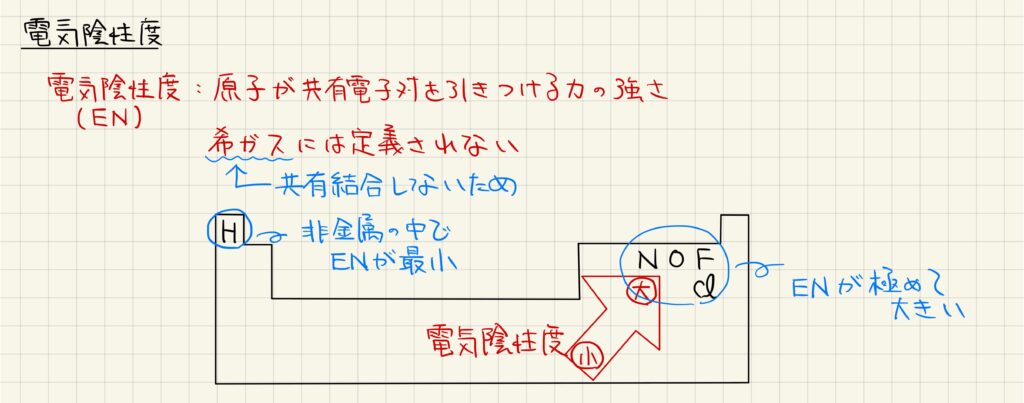
電気陰性度とは,原子が共有電子対を引きつける力の強さです。それぞれの元素に対して定義されていますが,希ガスは共有結合を形成しないため,電気陰性度は定義されていません。非金属元素の中では水素原子の電気陰性度が最も小さく,逆に窒素,酸素,フッ素,塩素といった元素の電気陰性度が非常に大きいです。
結合の極性
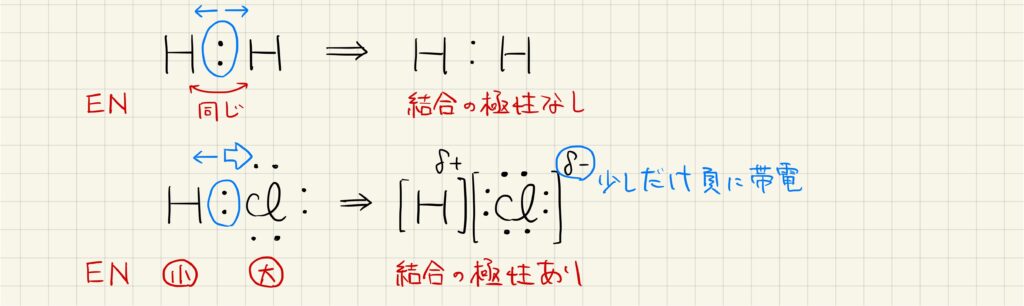
電気陰性度の違いにより,結合に極性が生じます。水素分子の場合には互いの原子で当然電気陰性度が同じなので,結合に極性は生じません。しかし,塩化水素の場合には水素よりも塩素の方が電気陰性度が大きく,共有電子対が塩素原子側に偏っています。このとき,結合に極性が生じており,少しだけ帯電している状態をδ+やδ-として表します。
分子の形と極性
決定手順

まずは,分子の形の求め方を見ていきましょう。初めに,形状を考える分子の電子式を描きます。次に,中心原子の周りに電子対がどのように広がっているのか確認します。多くは四方向で,正四面体方向に電子対が広がっています。最後に原子がどの位置に存在しているか見れば,分子の形を求めることができます。
次に,分子の極性の求め方を見ていきましょう。電気陰性度から,結合の極性を求めます。この極性をベクトルとして,分子全体でベクトル和をとります。ベクトル和が残っていれば極性分子,残っていなければ無極性分子となります。
例1:メタン
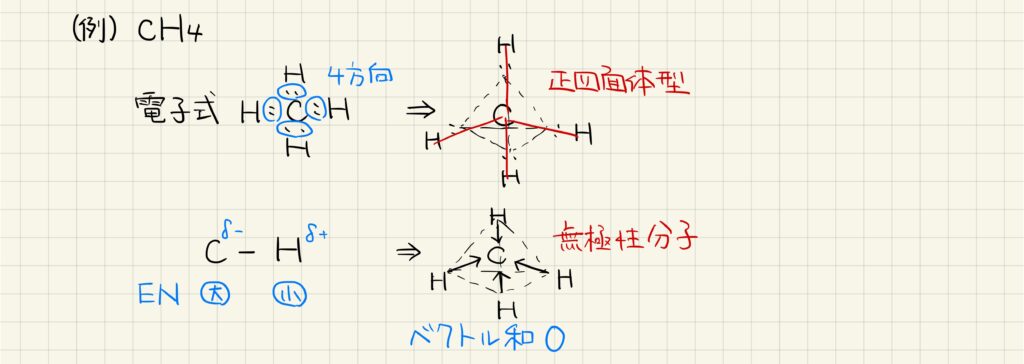
具体的に,メタンの形状や極性を求めていきましょう。電子式を見ると,炭素原子の周りに4方向に電子対が存在しています。したがって正四面体方向に電子が広がり,その全てに水素原子が存在しているので,メタンは正四面体型の分子だと分かります。
炭素と水素の電気陰性度は異なるので,結合に極性があります。ただし,4つの結合によってこれらの極性は打ち消され,分子全体としては無極性分子となります。
例2:アンモニア
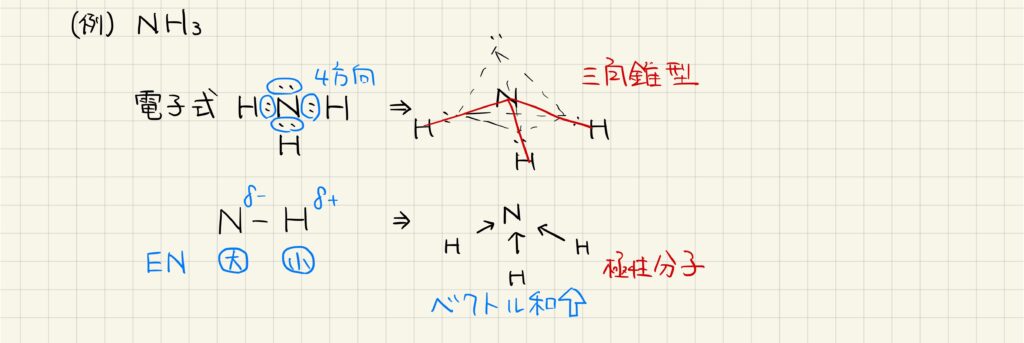
次に,アンモニア分子の形状や極性を求めていきましょう。電子式を見ると,窒素原子の周りに4方向の電子対があります。しかし,そのうち3つのみに水素が結合しているので,分子は三角錐型になります。
窒素と水素は電気陰性度が異なり,結合の極性があります。分子全体でベクトルを打ち消されないので,極性分子となります。













