このページのまとめ
学習のポイント
- 結晶の硬さは結晶をつくる力の強さで決まり、共有結合結晶が最も硬い。
- 電気伝導性は自由に動くことができる電荷が存在するかで決まり、固体では金属結晶と黒鉛が電気を通す。
- 分子間力にはファンデルワールス力と水素結合の2種類がある。
- 水素化合物の沸点は、水素結合の有無とファンデルワールス力の大きさの差で説明できる。
まとめノート
このページでは,結晶の性質について解説をしていきます。具体的には,結晶の硬さや電気伝導性,分子結晶に関しては沸点についてです。結晶にはそれぞれ特徴的な性質があり,結合の様子から関連付けて覚えるとわかりやすいです。また,分子結晶に関しては分子間力について理解することが大切です。順に見ていきましょう。
結晶の硬さ
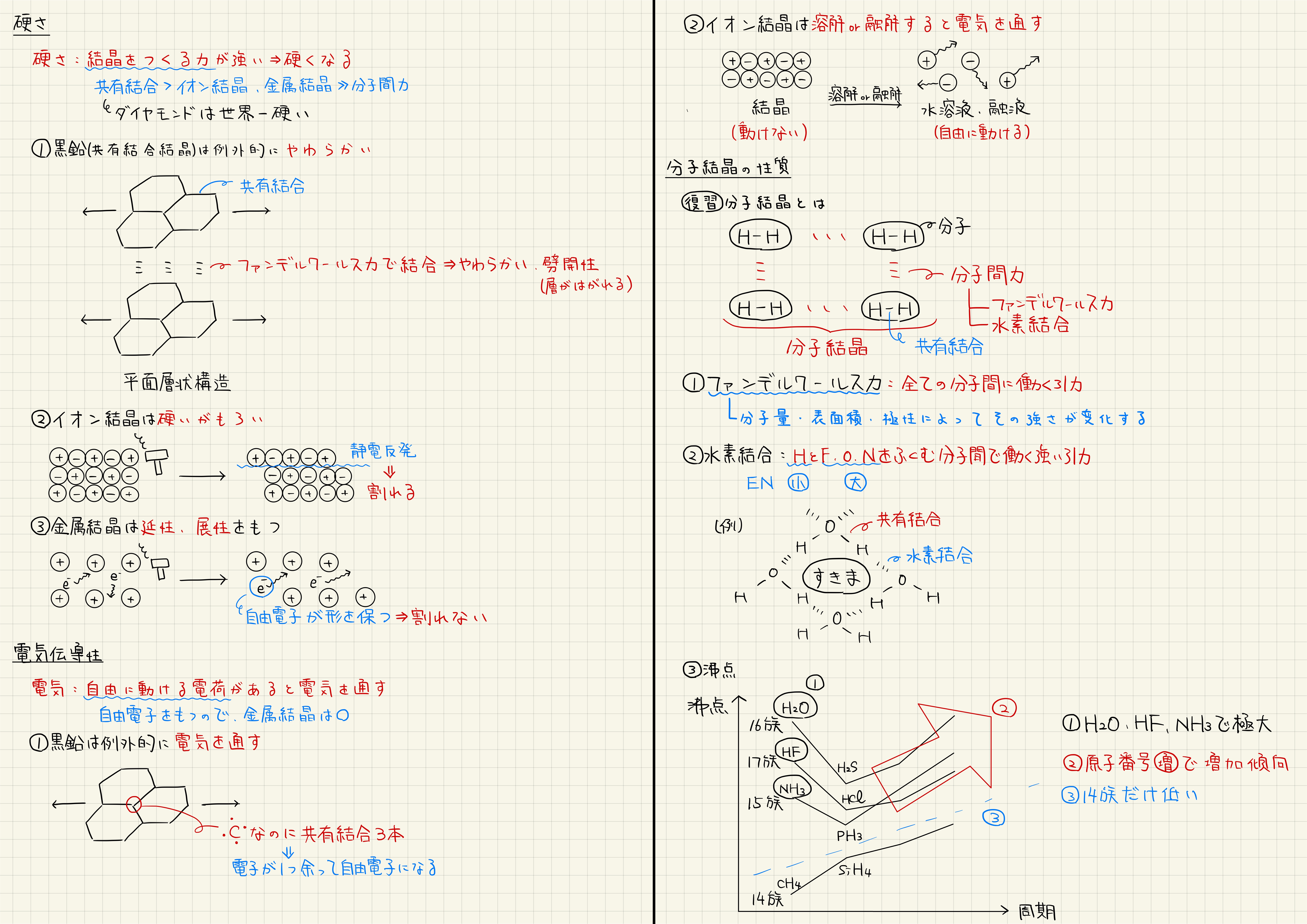
黒鉛の場合
結晶の硬さは,一般的には結晶を作る力の強さで決まります。結晶を作る力が強いと,硬い結晶となります。結合は共有結合,イオン結晶および金属結晶,分子間力の順に弱くなっていきます。したがって,一般的には共有結合結晶が最も硬い結晶で,ダイヤモンドは天然に存在する物質の中で最も硬いと知られています。
ただし,黒鉛は共有結合結晶でありながら柔らかい性質を示します。これは,黒鉛は平面層状構造をとっており,層と層の間は非常に弱いファンデルワールス力によって結合しています。この結合が切れやすいため,黒鉛は柔らかくなっています。また,同様の理由で黒鉛が劈開性を示すことも知られています。
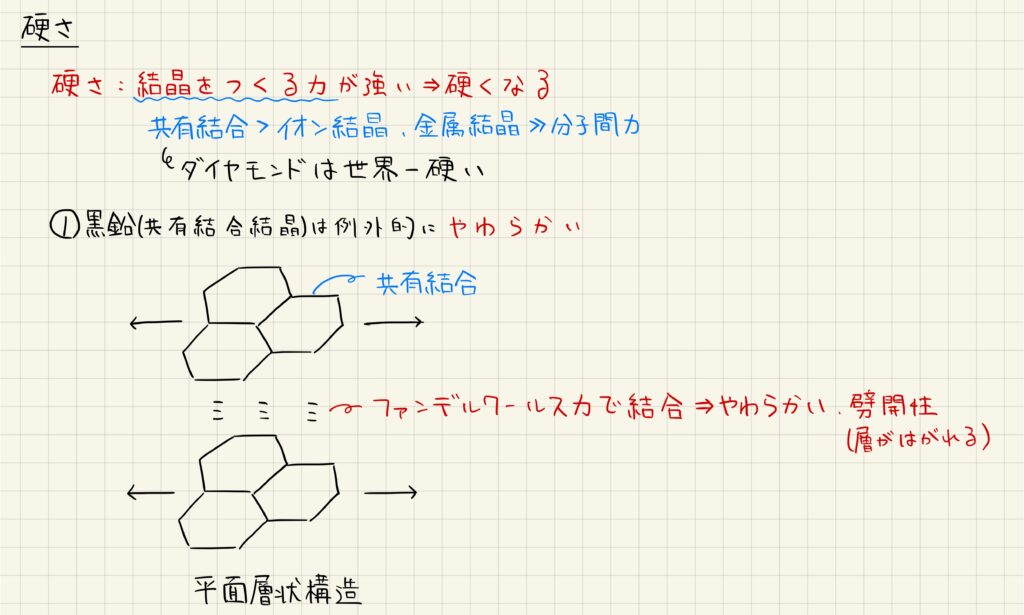
イオン結晶の場合
イオン結晶は硬いがもろい構造だと知られています。これは,イオン結晶に対して力が加わるとイオンどうしの静電反発によって結晶が壊れやすくなるためです。実際に岩塩は非常に硬いですが,ミルなどで容易に削ることができます。
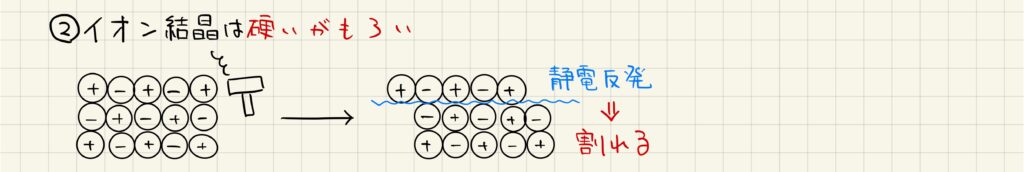
金属結晶の場合
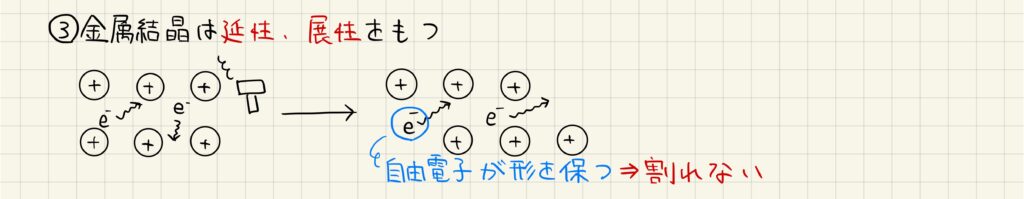
金属結晶は硬く,さらに延性や展性があります。延性とは延びる性質,展性とは曲がる性質です。金属結晶には自由電子が含まれているため,外部から力が加わって変形してもその形状を保つことができます。このような理由で,金属結晶特有の性質が実現しています。
結晶の電気伝導性
黒鉛の場合
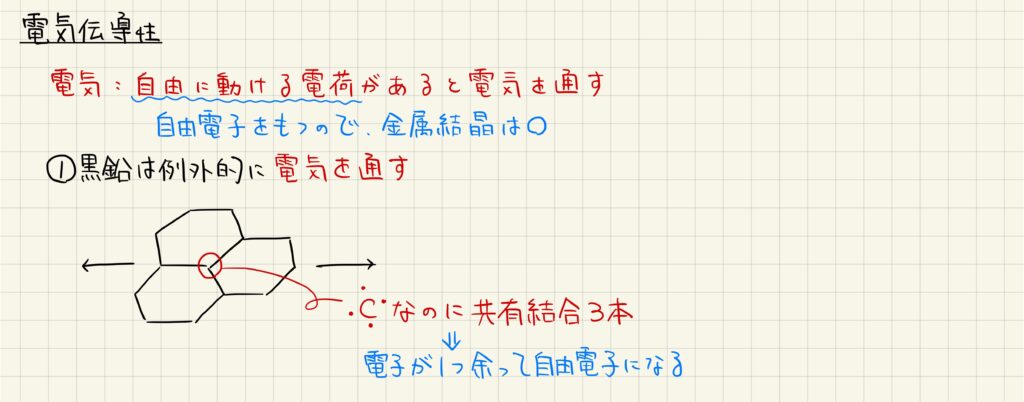
結晶の電気伝導性は,電荷を運搬することができるかどうかで決まります。例えば金属結晶は自由電子が電荷を運搬するので,常に電気を伝えることができます。
共有結合結晶は一般に電気を通さないですが,黒鉛は例外的に電気を通します。黒鉛の結晶構造を見ると炭素原子が3本の共有結合を形成しており,残った不対電子1つが自由電子のように振舞います。このため,黒鉛は電気を通すことができます。
イオン結晶の場合
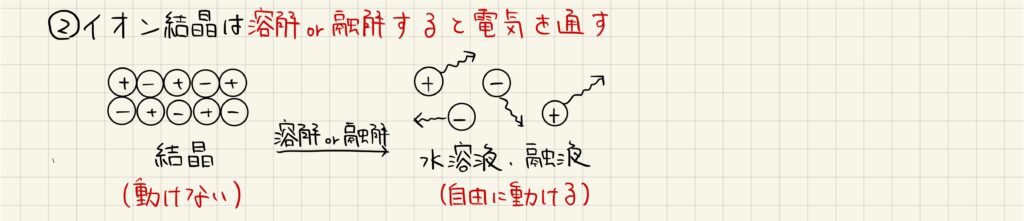
イオン結晶は固体の状態では電気を通さないですが,融解させたり水に溶解させたりすると電気を通します。これは,融解,溶解によってイオンが自由に移動できるようになり,電荷を運搬できるからです。
分子結晶の性質
分子結晶の成り立ち
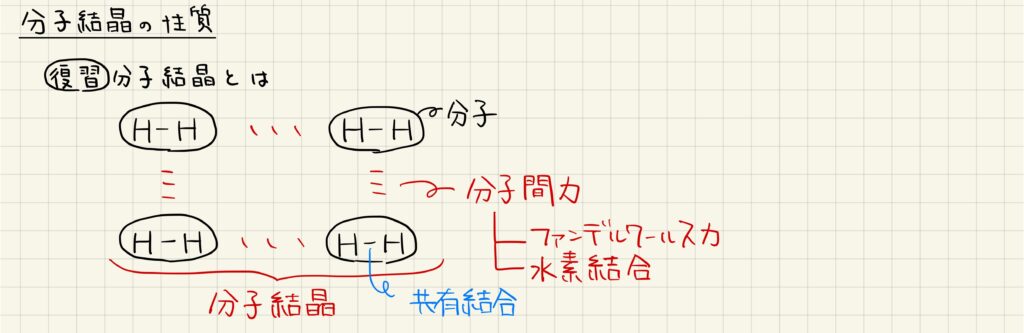
分子結晶とは,非金属原子どうしが共有結合して分子を形成し,分子どうしが分子間力によって結合することで形成しています。分子間力にはファンデルワールス力と水素結合があり,それぞれ性質が異なります。
分子間力
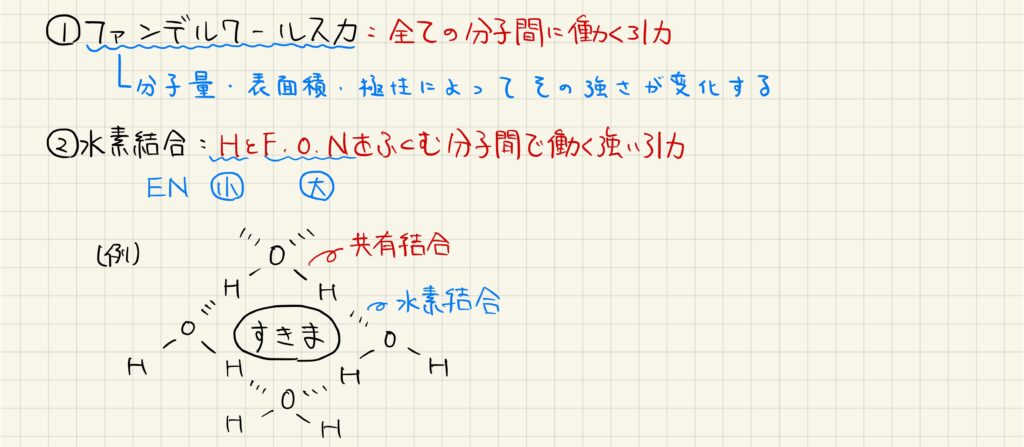
ファンデルワールス力は,全ての分子間に働く非常に弱い力です。分子量・表面積・分子の極性によってその力の大きさが異なります。一方,水素結合は,水素原子とフッ素・酸素・窒素原子の間で働く非常に強い力です。電気陰性度が水素は小さく,フッ素・酸素・窒素は非常に大きいため,分子の極性が大きくなり,強い結合が生まれます。例えば氷の結晶は水素結合によって隙間の多い構造が作られており,これによって水よりも密度が小さくなっています。
分子結晶の沸点
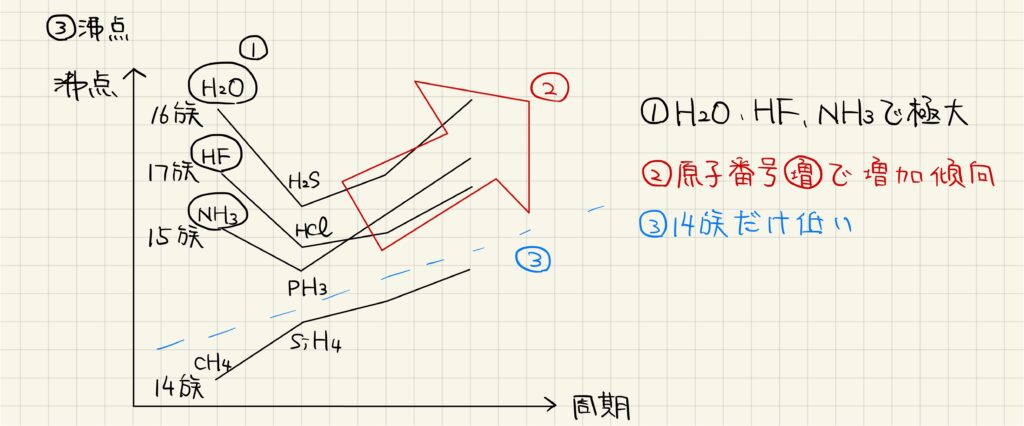
水素化合物の沸点について比較していきます。
①水,フッ化水素,アンモニアの沸点がかなり高くなっています。これは,これらの分子は分子間で水素結合を形成しており,強く結び付いているからです。
②全体的に,原子番号が増加するにつれて沸点が高くなる傾向があります。これは,原子番号が大きくなることで分子の分子量が大きくなり,分子間のファンデルワールス力が強くなるからです。
③第14族元素の水素化合物は他の化合物と比較して沸点が低くなっています。これは,第14族元素の水素化合物は全て無極性分子なのに対して,他の化合物は極性分子であり,ファンデルワールス力の強さに差があるからです。













