このページのまとめ
学習のポイント
- 金属元素は電子を放出して陽イオンになりやすい元素、非金属元素は電子をもらって陰イオンになりやすい元素のこと。
- 金属と非金属がイオン結合をしてイオン結晶を形成する。
- 金属と金属が自由電子を放出して金属結合を形成し、金属結晶をつくる。
- 非金属どうしでは共有結合が生じ、共有結合結晶や分子結晶をつくる。
- 配位結合は、片方の原子がもつ電子対を共有することでできる結合である。
まとめノート
このページでは,結晶の構造や配位結合について解説していきます。結晶はイオン結晶,金属結晶,共有結合結晶,分子結晶の4種類があり,それぞれが異なる成り立ちをしています。各結晶がどのようにできているのか理解していきましょう。また,結合の種類として少し得意な配位結合について解説します。共有結合との違いに注意しながら見ていきましょう。
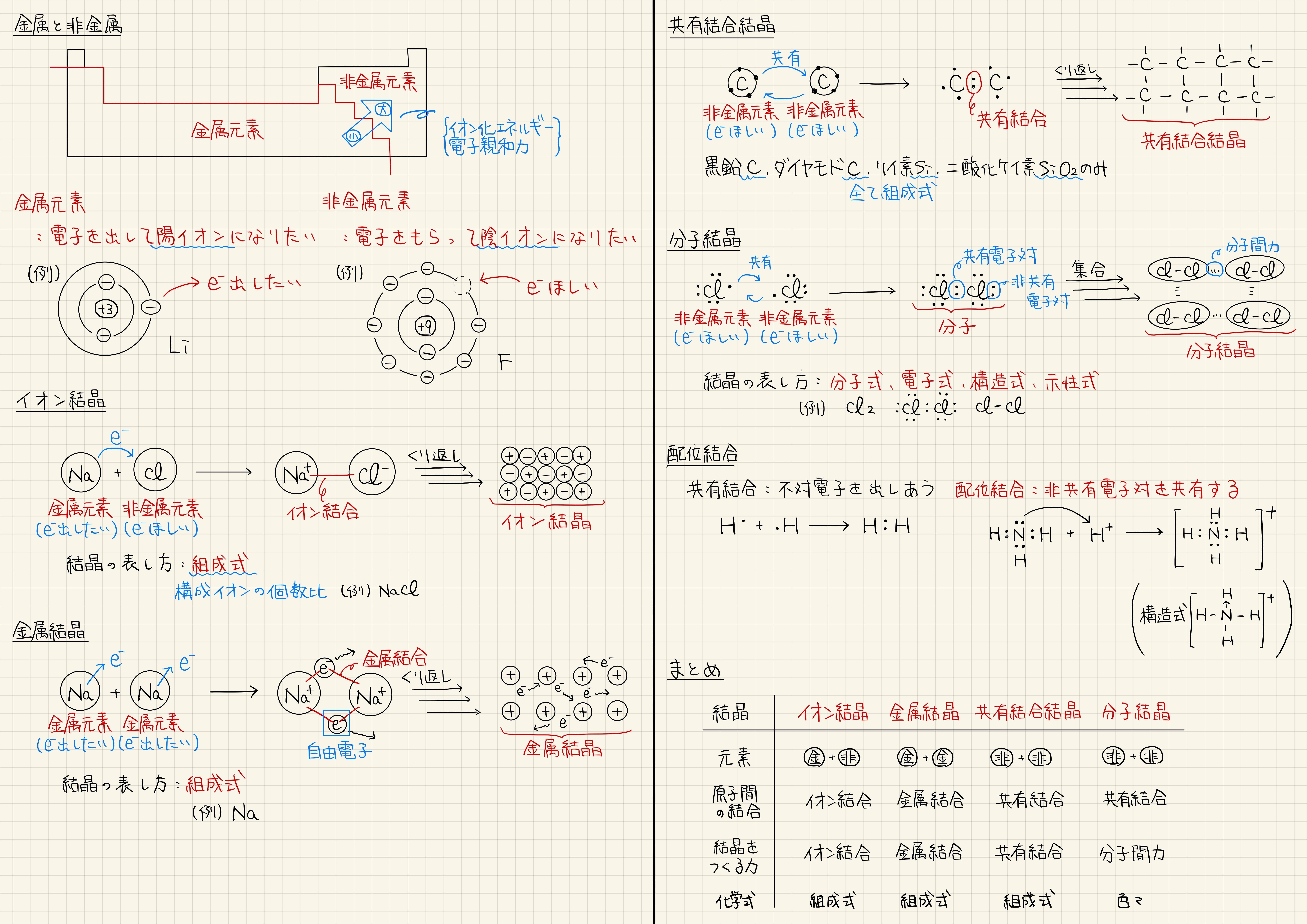
金属と非金属
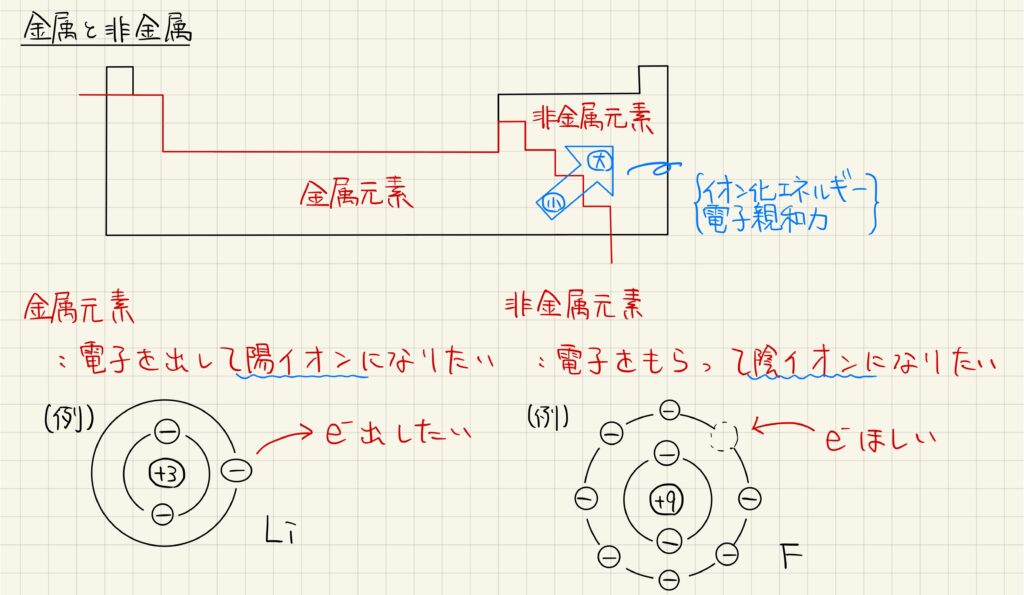
元素は,金属元素と非金属元素に分類されます。この分類が後の結晶の成り立ちを理解する上で重要になりますから,よく見ておきましょう。金属元素とは,電子を放出して陽イオンになりやすい原子の総称を言います。一方,非金属元素とは,電子を受け取って陰イオンになりやすい原子の総称を言います。イオン化エネルギーや電子親和力は元素周期表において右上に位置する元素で大きくなるので,周期表において非金属元素が右上,金属元素は左下に位置しています。
結晶の成り立ち
イオン結晶
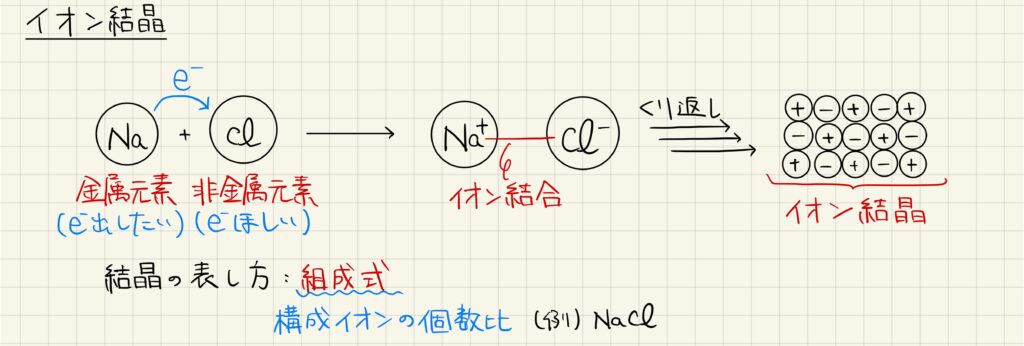
電子を放出したい金属原子と,電子を受け取りたい非金属原子が結合する時,電子の受け渡しが起こります。この時,陽イオンと陰イオンの間に静電気力が働いて結合しています。この結合を特にイオン結合と呼びます。陽イオンと陰イオンが多数集まり,無数のイオン結合によって形成されるのがイオン結晶です。イオン結晶を化学式で表す際には組成式を用います。
金属結晶
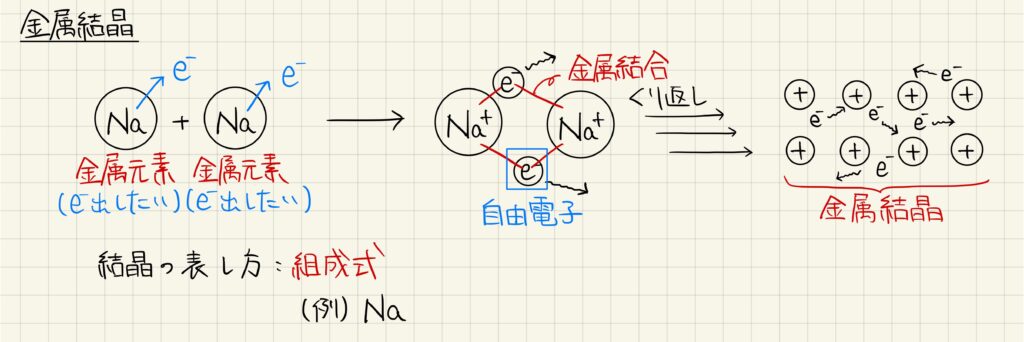
金属原子が電子を放出して陽イオンになる一方,放出された電子は自由電子となります。自由電子を介して陽イオンどうしが結合しており,これを金属結合と呼びます。陽イオンが多数集まり,金属結合によってできる結晶を金属結晶と呼びます。金属結晶を化学式で表すときは組成式を用います。
共有結合結晶
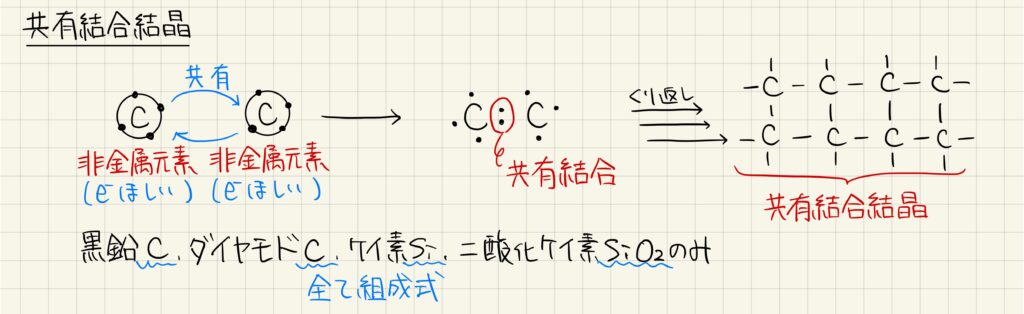
お互いに電子が欲しい非金属原子どうしでは,共有結合が生じます。共有結合が無数に繰り返されてできる結晶を共有結合結晶と呼びます。高校化学の範囲で扱う共有結合結晶は非常に少なく,黒鉛,ダイヤモンド,ケイ素,二酸化ケイ素のみとなります。それぞれ化学式で表す時には組成式で書きます。
分子結晶
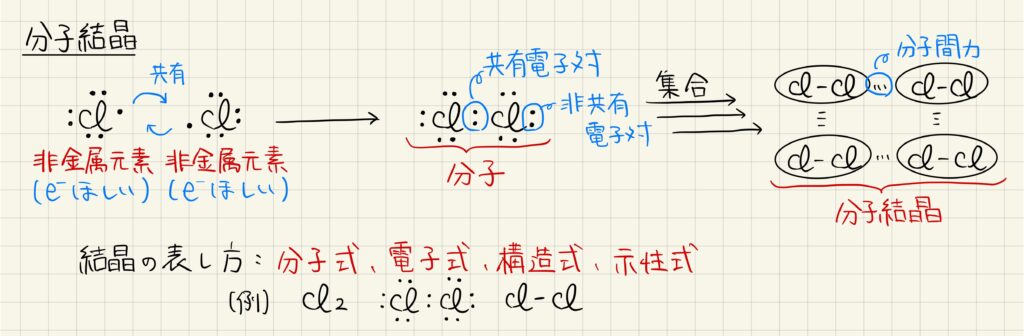
共有結合によっていくつかの原子がまとまって,分子を作ることができます。分子の中で,共有結合に使われている電子対は共有電子対,共有結合に使われていない電子対は非共有電子対と呼びます。分子は分子間力という力によって引きつけられ,分子結晶を形成します。分子結晶は分子式,電子式,構造式,示性式など様々な化学式で表されます。
配位結合
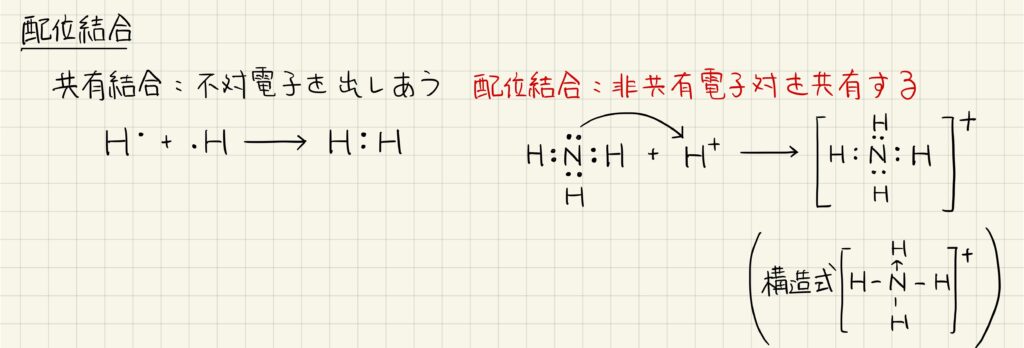
非金属原子どうしが結合する時,一般には共有結合が形成されます。共有結合では互いの電子の不対電子が共有されて共有電子対となります。一方,非共有電子対を共有する形で結合するものを配位結合と呼びます。構造式では,配位結合は電子を受け渡す方向に矢印で表現します。
結晶のまとめ

これまで扱った結晶についてまとめておきましょう。結晶は,イオン結晶,金属結晶,共有結合結晶,分子結晶の4種類があります。分子結晶以外は原子間の結合がそのまま繰り返されて結晶が形成されています。しかし,分子結晶では原子間は共有結合で結合していますが,結晶は分子間力によって形成されています。化学式の表し方も様々ありますから,違いをよく覚えておきましょう。