このページのまとめ
学習のポイント
- 原子が希ガスの電子配置を目指して電子の授受を行った結果、イオンが生成される。
- 陽イオンの生成では原子よりも半径が小さくなる。一方で、陰イオンの生成では原子よりも半径が大きくなる。
- イオン化エネルギーとは、原子が陽イオンになるときに必要になるエネルギー。
- 電子親和力とは、原子が陰イオンになる際に放出するエネルギー。
まとめノート
今回は,イオンについて学んでいきます。原子から電子を奪うことで陽イオンが生成でき,逆に原子に電子を付与することで陰イオンが生成できます。陽イオンや陰イオンを生成するときにはエネルギーの出入りがあり,それぞれイオン化エネルギーと電子親和力と呼びます。
【イオンとは】電子の授受により原子がイオンになる
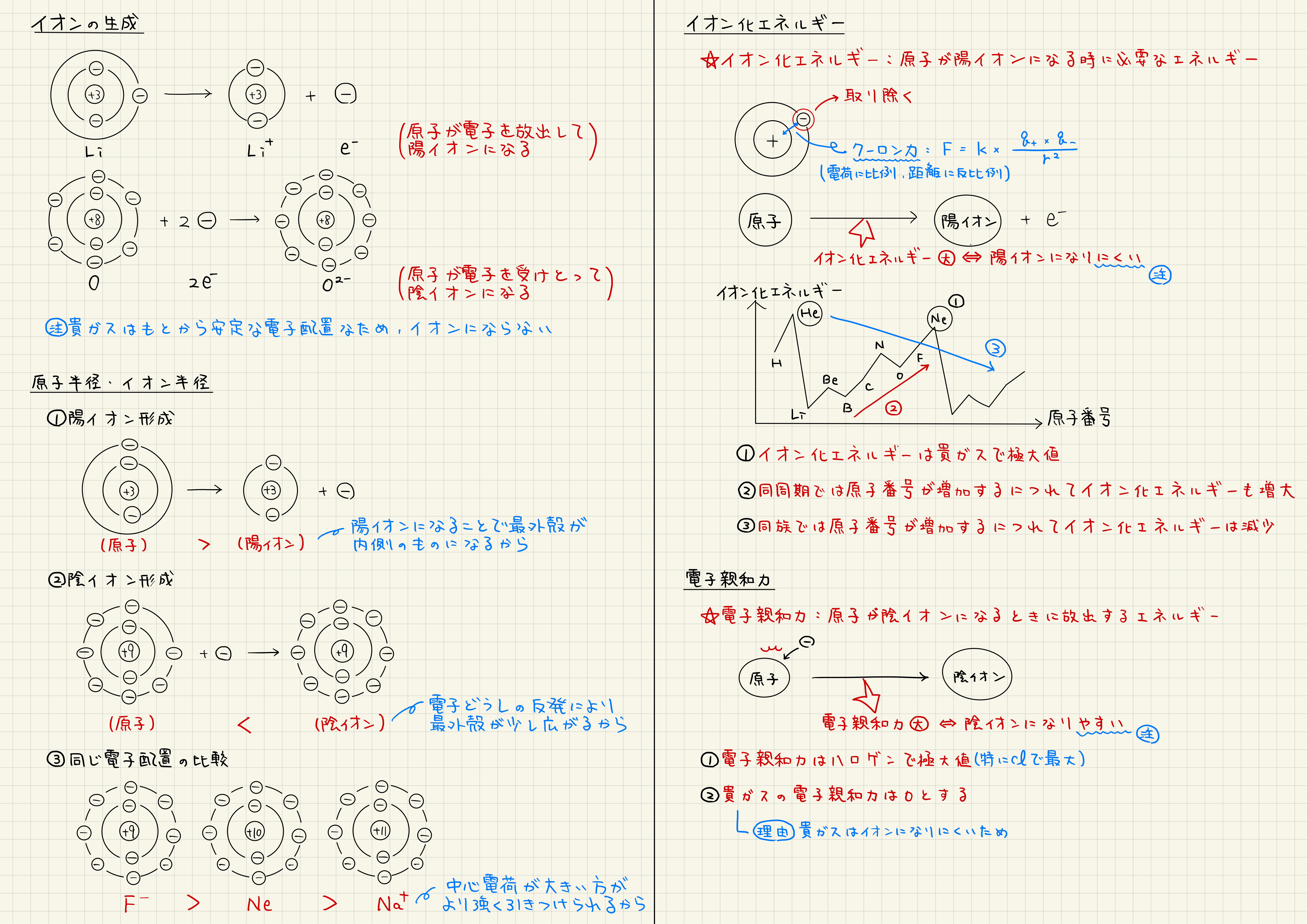
イオンの生成
原子から電子の授受を経てイオンを生成することができます。原子の状態では不安定な電子配置となっているとき,安定な貴ガスの電子配置を目指して電子の授受が行われます。原子が電子を放出すれば陽イオン,電子を受け取れば陰イオンを生成することになります。なお,貴ガス原子はもともと安定な電子配置をしているため,イオンにはなりません。
授受したイオンの数を価数と呼びます。例えば,Li原子は電子を1つ放出して一価の陽イオンであるLi+を形成します。また,O原子は電子を2つ受け取って二価の陰イオンであるO2-を形成します。ここで,価数の表記は(数字→±)の順で書きます。O-2という間違いが多いので,注意しましょう。
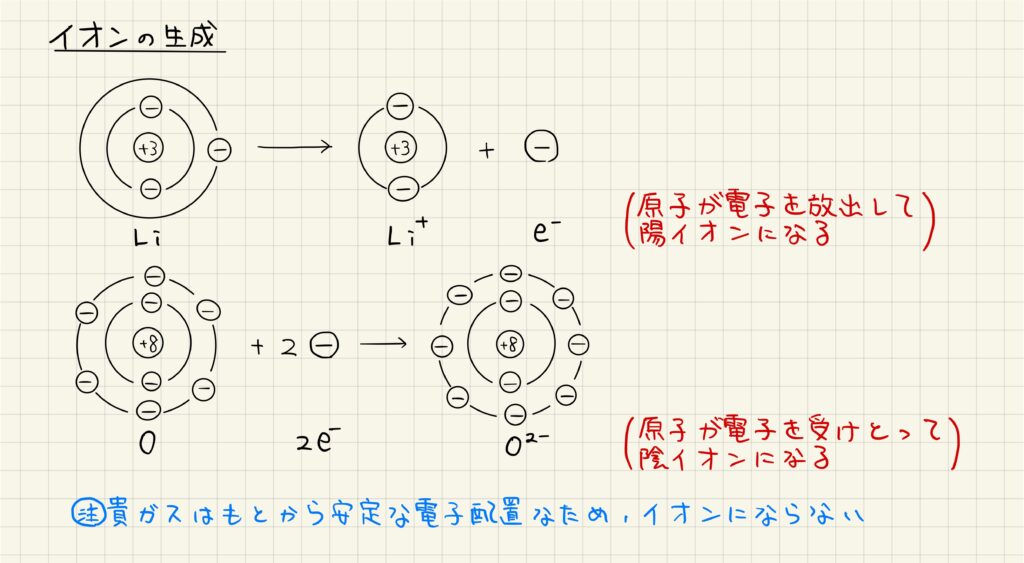
原子半径・イオン半径
原子やイオンの大きさを比較してみましょう。原子から陽イオンになる時は最外殻が内側のものに変化するので,原子>陽イオンの大きさとなります。
原子から陰イオンになる時は最外殻の電子数が増えるので,陰イオンの方が電子どうしの反発が大きくなり,全体として原子<陰イオンの大きさとなります。
同じ貴ガスの電子配置で比較すると,原子番号が大きいものの方が小さくなります。これは,中心電荷が大きい原子やイオンほど電子が強く引きつけられて,電子が内側に寄っていくからです。
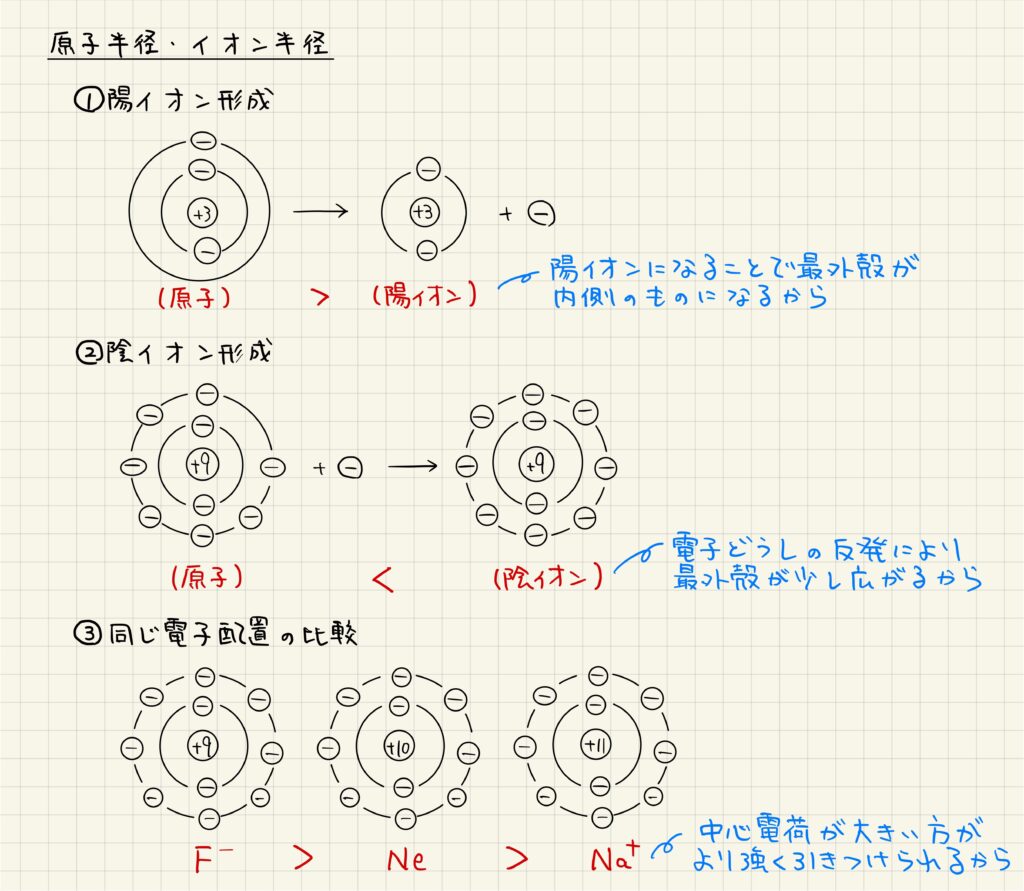
【イオン化エネルギー】陽イオンになるときに必要なエネルギー
原子が陽イオンになるときに必要なエネルギーをイオン化エネルギーと呼びます。原子の中心電荷と電子は静電気力(クーロン力)で引きつけあっているので,これを断ち切るためにイオン化エネルギーが必要となります。イオン化エネルギーが大きいほどイオンになりにくいです。原子から電子を1つ奪うのに必要なエネルギーを第一イオンかエネルギー2つ目を奪うのに必要なエネルギーを第二イオン化エネルギーと呼びます。
原子ごとの第一イオン化エネルギーの大きさはグラフで示した通りです。イオン化エネルギーが貴ガス原子で極大値を取るのは,「貴ガス原子は閉殻構造またはオクテットの状態という非常に安定な電子配置をとっており,イオンになるために非常に大きなエネルギーが必要となるから」です。
元素周期表における同周期でイオン化エネルギーが増加傾向にあるのは,「同周期では最外殻は同じですが,原子番号が増加するにつれて原子核の正電荷が大きくなり,より強い力で電子を引き付けるようになるから」です。
元素周期表における同族でイオン化エネルギーが減少傾向にあるのは,「同族では原子番号が増加するにつれて最外殻が外側のものになり,中心電荷が電子を引き付ける力が弱くなるから」です。
【電子親和力】陰イオンになるときに放出するエネルギー
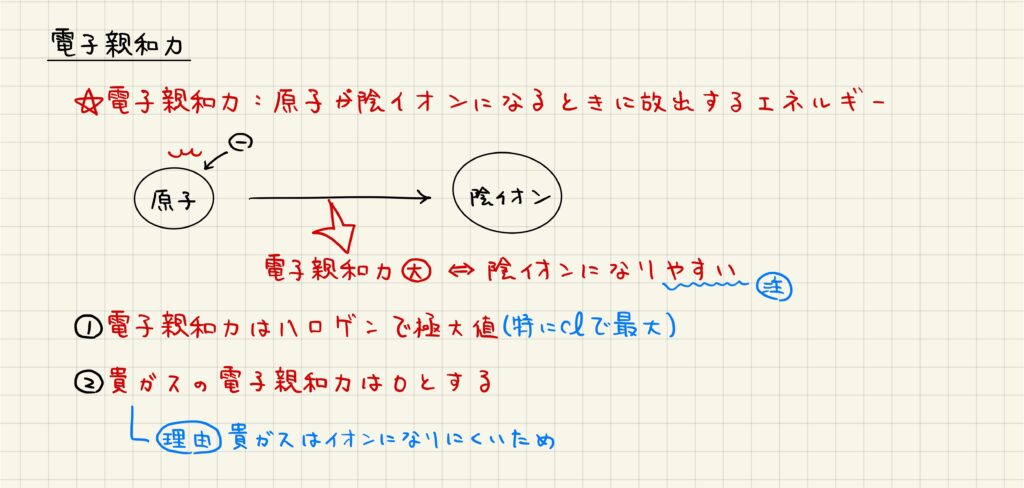
原子が陰イオンになるときに放出するエネルギーのことを電子親和力と呼びます。電子親和力が大きいほど安定な陰イオンを形成できるため,陰イオンになりやすいです。
電子親和力はハロゲンの原子で極大値を取ります。これは,ハロゲンの原子が電子を1つ受け取ることで安定な貴ガスの電子配置になることができるためです。また,貴ガスは電子親和力を0として考えます。これは,貴ガスはもともと安定な電子配置であり,最も陰イオンになりにくい原子だからです。













