このページのまとめ
- ヨウ素滴定は、酸化還元反応を利用して還元剤の濃度を測定する方法。
- ヨウ素(I₂)が還元剤と反応して、I⁻に変わる過程を利用。
- デンプン指示薬で青紫色が現れ、終点では色が消える。
- ビタミンCや硫化物の濃度測定に使われる。
~先生と生徒の会話~
 生徒
生徒ヨウ素滴定ってどういう原理で行われるんですか?



ヨウ素滴定は、酸化還元反応を利用して行う滴定法の一つで、特に還元剤の濃度を求める際に使われるんだ。ヨウ素(I₂)は酸化剤として働いて、還元剤と反応する。反応の過程で、ヨウ素はI⁻(ヨウ化物イオン)に還元されて、還元剤は酸化される。この反応を利用して、滴定の終点を見極めることができるんだよ。



それって、過マンガン酸カリウム滴定と似たような方法なんですか?



そうだね、酸化還元反応を利用している点では同じだよ。でも、過マンガン酸カリウム滴定は酸化剤としてMnO₄⁻を使うのに対して、ヨウ素滴定ではI₂を使って還元剤と反応させるところが違うんだ。また、滴定の終点を視覚的に確認するために、デンプン指示薬がよく使われるよ。ヨウ素とデンプンが反応すると青紫色になるから、その色が消えることで反応が完了したことがわかるんだ。



デンプンが指示薬として使われるんですね!反応が終わると青紫色が消えるんですね。



そうなんだ。この色の変化がヨウ素滴定の特徴的な部分だよ。ヨウ素滴定では、反応が進むにつれてI₂が還元されてI⁻になるけど、デンプンと反応して青紫色を作るのはI₂だけだから、全てのI₂が反応してしまうと色がなくなるんだ。この色の消失をもって、滴定の終点とするんだよ。
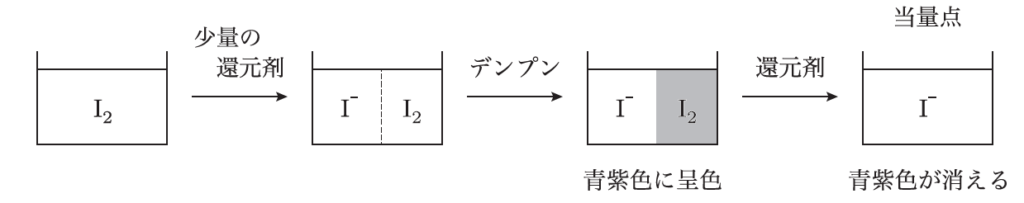




なるほど、滴定の終点が視覚的にわかるのは便利ですね。具体的にはどんな物質を分析するときにヨウ素滴定が使われるんですか?



ヨウ素滴定は、ビタミンC(アスコルビン酸)や硫化物のような還元剤の濃度を測定するときによく使われるよ。ビタミンCは健康にも関係が深いから、食品中のビタミンC含有量を測定する実験なんかで使われることが多いね。ビタミンCが酸化されて脱水デヒドロアスコルビン酸に変わると同時に、ヨウ素が還元されてI⁻に変わる。この反応を基にして、ビタミンCの濃度を正確に測定できるんだ。



ビタミンCの濃度を測定できるんですね!日常生活にもつながる実験なんだ。



そうだよ。ヨウ素滴定は化学の授業でもよく出てくるし、食品分析でも重要な役割を果たしているんだ。さらに、ヨウ素滴定は比較的簡単に行えるから、学校の実験や工場での品質管理にも使われることが多いんだよ。滴定方法としては、手軽でありながらも結果がしっかり得られるので、様々な分野で応用されているんだ。
例題&解答
【例題1】
0.01 mol/Lのヨウ素溶液を用いて、ビタミンC(アスコルビン酸)10 mLの濃度を測定したところ、ヨウ素溶液が15 mL消費された。このビタミンC溶液の濃度を求めなさい。
【解答】
反応式: C₆H₈O₆ + I₂ → C₆H₆O₆ + 2I⁻ + 2H⁺
ヨウ素溶液のモル数 = 0.01 mol/L × 0.015 L = 0.00015 mol
反応式から、ビタミンCとI₂は1:1で反応するため、ビタミンCのモル数も0.00015 mol
ビタミンC溶液の濃度 = 0.00015 mol / 0.01 L = 0.015 mol/L
【例題2】
デンプン指示薬を使ってヨウ素滴定を行い、終点で青紫色が消えた。もし、ヨウ素溶液の濃度が0.02 mol/Lで、15 mL消費されたときの、硫化物のモル数を求めなさい。
反応式: S²⁻ + I₂ → S + 2I⁻
ヨウ素溶液のモル数 = 0.02 mol/L × 0.015 L = 0.0003 mol
反応式から、硫化物とI₂は1:1で反応するため、硫化物のモル数は0.0003 mol


.jpg)
-300x169.jpg)

-300x169.jpg)







