このページのまとめ
- 過マンガン酸カリウム滴定は、酸化還元反応を利用して、物質の濃度を計算する方法。
- 滴定の終点は、過マンガン酸カリウムの赤紫色が消えなくなった点で確認できる。
- 酸性条件でMnO₄⁻が5つの電子を受け取り、Mn²⁺に還元される。
- 滴定を行う際には、酸化剤として働く過マンガン酸カリウムと還元剤(Fe²⁺やC₂O₄²⁻など)が反応する。
~先生と生徒の会話~
 生徒
生徒過マンガン酸カリウム滴定って、どういう原理で行われるんですか?



過マンガン酸カリウム(KMnO₄)は強力な酸化剤として使われるから、酸化還元反応を利用して行われる滴定方法だよ。特に酸性条件下で、過マンガン酸イオン(MnO₄⁻)が電子を受け取り、酸化数が変化して還元される。このとき、赤紫色の過マンガン酸カリウムが無色になるので、滴定の終点が視覚的に確認できるんだ。
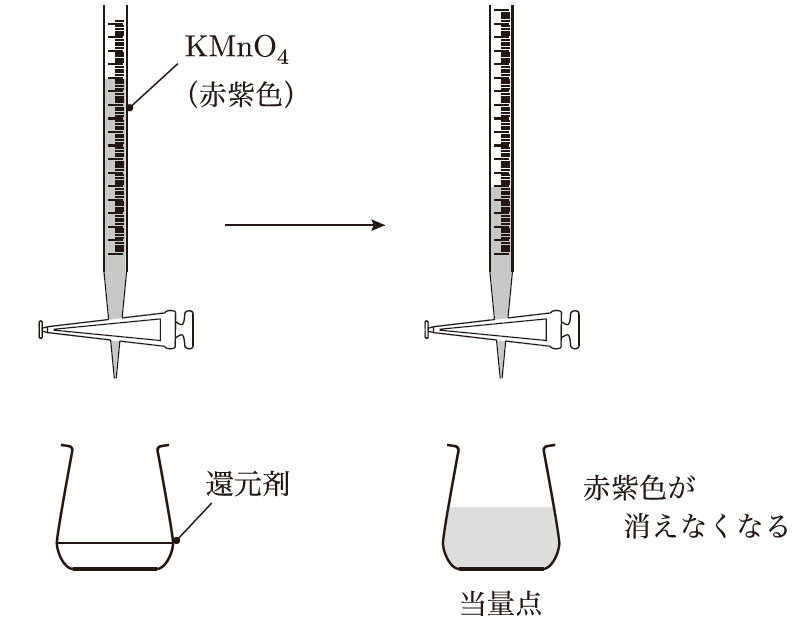




滴定の終点が色の変化でわかるって便利ですね!反応の途中ではどうなっていますか?



そうだね、過マンガン酸カリウム滴定では反応の進行中は溶液が紫色を保っているんだけど、酸化還元反応が終わると過マンガン酸カリウムの赤紫色が完全になくなって無色になる。だから、滴定中は少しずつKMnO₄を滴下しながら、色の変化を観察するんだ。最後に一滴で赤紫色が残るようになったら、それが滴定の終点になるよ。この反応では、MnO₄⁻が5個の電子を受け取り、Mn²⁺に還元される。



酸化数の変化が5つもあるんですね!じゃあ、この反応式を使って、Fe²⁺やC₂O₄²⁻の濃度を計算することができるんですね。



その通り!たとえば、Fe²⁺とMnO₄⁻の反応式はこうなるんだ:



5Fe²⁺ + MnO₄⁻ + 8H⁺ → 5Fe³⁺ + Mn²⁺ + 4H₂O



この反応を基にして、滴定に使ったKMnO₄の体積と濃度からFe²⁺の量を計算することができる。同じように、シュウ酸との反応式を使ってシュウ酸の濃度も求めることができるんだよ。



なるほど!反応式に基づいて正確に濃度を計算できるんですね。実験では酸性条件下で行われると言っていましたが、どうして酸性条件が必要なんですか?



酸性条件はMnO₄⁻が安定して反応するために必要なんだ。酸性条件がないと、過マンガン酸カリウムは異なる反応経路を取ってしまって、期待した結果にならないことがあるんだ。特に、硫酸(H₂SO₄)がよく使われるよ。酸があることでMnO₄⁻がMn²⁺に効率よく還元されるんだ。
【例題1】
0.02 mol/Lの過マンガン酸カリウム溶液を用いて、0.1 mol/Lの鉄(II)イオン溶液50 mLを滴定した場合、反応に使われるKMnO₄の体積を求めなさい。
【解答】
反応式: 5Fe²⁺ + MnO₄⁻ + 8H⁺ → 5Fe³⁺ + Mn²⁺ + 4H₂O
Fe²⁺のモル数 = 0.1 mol/L × 0.05 L = 0.005 mol
KMnO₄のモル数はFe²⁺の1/5なので、0.001 mol必要。
体積 = モル数 / 濃度 = 0.001 mol / 0.02 mol/L = 0.05 L = 50 mL
【例題2】
0.025 mol/Lの過マンガン酸カリウムを用いて、シュウ酸(C₂O₄²⁻)を滴定した。もしシュウ酸が0.0025 mol含まれている場合、滴定に必要なKMnO₄の体積を求めなさい。
【解答】
反応式: 2MnO₄⁻ + 5C₂O₄²⁻ + 16H⁺ → 2Mn²⁺ + 10CO₂ + 8H₂O
C₂O₄²⁻のモル数は0.0025 mol。
KMnO₄のモル数はC₂O₄²⁻の2/5なので、0.001 mol必要。
体積 = モル数 / 濃度 = 0.001 mol / 0.025 mol/L = 40 mL





-300x169.jpg)







