このページのまとめ
- 電離は、物質が溶液中でイオンに分かれる現象。
- 電離平衡は、電離したイオンと元の分子の間でバランスが取れている状態。
- 外部の条件(濃度や温度)によって電離平衡が変化する。
- 電離定数(KaやKb)を使って、酸や塩基の電離の度合いを示すことができる。
~先生と生徒の会話~
 生徒
生徒物質が水に溶けるとイオンに分かれる現象を「電離」と呼ぶことは理解したんですが、全てが完全に電離するわけではないですよね?部分的に電離する物質はどうなるんですか?



そうだね、物質によっては完全に電離せず、一部が分子のままで残ることがあるんだ。これを「電離平衡」と呼んでいて、電離したイオンと元の分子が平衡状態を保っているんだ。つまり、反応が一方向に進むだけでなく、逆方向にも進むことで、電離しているイオンの量が一定に保たれているんだよ。



電離平衡って、生成物と反応物の間で反応が進むスピードが同じだから見た目に変化がない、という状態ですね。化学平衡と似ている感じですか?



そうそう!電離平衡も化学平衡の一種なんだ。例えば、酢酸(CH₃COOH)は水に溶けると、一部がH⁺とCH₃COO⁻に分かれるけど、分子のCH₃COOHもそのまま残るんだ。この状態で、電離したイオンが反応して再び分子に戻る反応も同時に起こっていて、そのバランスが取れているんだよ。このバランスが取れている状態を電離平衡というんだ。



なるほど!電離してイオンになったり、逆に戻ったりしてるんですね。じゃあ、どんな条件で電離平衡が崩れたりするんですか?



電離平衡が崩れるのは、外部の条件が変わったときだね。例えば、溶液の濃度を変えたり、温度を上げたりすると、電離平衡が崩れて反応が進む方向が変わるんだ。これはルシャトリエの原理でも説明されているように、システムが外部からの影響に対してバランスを取り直そうとするんだよ。だから、濃度が高くなれば電離が進む方向に反応が進み、逆にイオンの濃度が増えれば分子に戻る方向に反応が進むんだ。



ああ、環境が変わると平衡状態も変わって、電離の程度が変わるんですね。それにしても、どうして電離平衡が重要なんですか?



電離平衡は、溶液の酸性度や塩基性、さらには導電性に影響を与えるから重要なんだ。例えば、弱酸や弱塩基がどの程度電離しているかによって、その溶液のpHが決まるんだよ。酢酸の電離平衡が大きくなればpHが低くなって酸性が強まるし、逆に電離が少なければpHはあまり変わらない。また、電離平衡は医薬品や化学反応の速度にも影響を与えるから、工業的なプロセスでも非常に重要なんだ。



なるほど、電離平衡を理解しておくと、pHの調整や化学反応の管理がしやすくなるんですね。電離平衡がどれくらい進んでいるかを知る方法ってあるんですか?



電離定数(KaやKb)を使って電離平衡の度合いを知ることができるんだよ。Kaは酸の電離定数で、酸がどの程度電離しているかを示す。数値が大きければ酸が強く、電離が進んでいることを意味するし、小さければ弱酸ということだね。同じように、Kbは塩基の電離定数で、塩基がどの程度プロトンを受け取るかを示しているんだ。
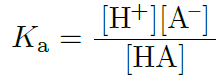
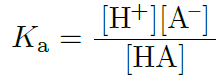
例題&解答
【例題1】酢酸(CH₃COOH)の電離平衡において、次の変化が起きたとき、反応がどのように進むかを説明しなさい。
1. 酢酸の濃度を増加させた場合
2. 水素イオン(H⁺)を加えた場合
- 酢酸の濃度が増加すると、反応は電離が進む方向(H⁺とCH₃COO⁻を生成する方向)に進む。
- H⁺を加えると、反応は逆方向に進み、酢酸分子(CH₃COOH)が生成される。
【例題2】次の電離定数が与えられたとき、どちらの酸が強いかを説明しなさい。
・酢酸:Ka = 1.8 × 10⁻⁵
・塩酸:Ka = 1.0 × 10⁶
塩酸のKaの値が酢酸のKaの値よりも大きいため、塩酸のほうが酢酸よりも強い酸であり、電離がより進んでいる。













