このページのまとめ
学習のポイント
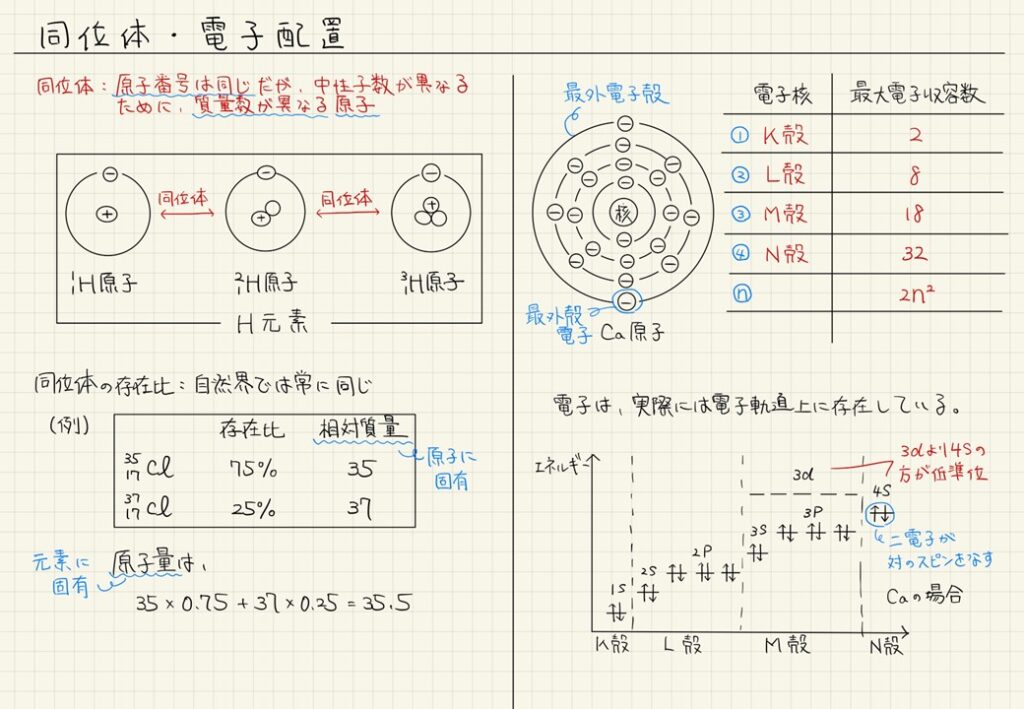
- 同位体は、陽子の数が同じで中性子の数が異なる原子のこと。
- 電子はエネルギーの異なる電子殻に配置され、内側からn番目の殻には最大2n²個の電子が入る。
- 電子配置は、電子がどの電子殻にいるかを示し、化学的性質に影響を与える。
- 最外殻の価電子は、化学反応において重要な役割を果たす。
- 電子は電子軌道に存在し、その位置は確率で決まる。
まとめノート
~先生と生徒の会話~
 先生
先生今日は「同位体」、「電子殻」、「電子配置」について話していこうか。まず、原子の中身について少し考えてみよう。たとえば、君が持っているペンや机、それらの物質は全部原子からできているんだ。



そうですね。全部原子でできているって言われても、まだその「原子」がよくわからないです…。



その気持ち、わかるよ。原子って目には見えないけれど、すべての物質の基礎なんだ。しかも、同じ種類の原子でも、いろいろなバリエーションがあるんだよ。それが同位体だ。



同位体って何ですか?



簡単に言うと、同位体とは、同じ元素でも陽子の数は同じだけど、中性子の数が違う原子のことだよ。たとえば、水素には軽水素、重水素と三重水素がある。どれも陽子は1個だけど、中性子の数が違うから、質量が変わってくるんだ。こういうバリエーションを同位体って言うんだ。





中性子の数が違うだけで、別の種類になるんですね。



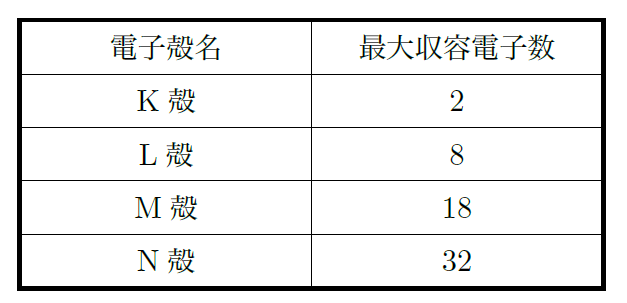
そうだね。では次に、電子殻について話そうか。電子は原子核の周りを回っているんだけど、決まった電子殻と呼ばれる層に配置されているんだ。原子核に一番近い殻から順に、K殻、L殻、M殻という名前がついている。



どの電子殻に電子が入るのか、どうやって決まるんですか?



いい質問だね!電子殻には、それぞれ入ることができる電子の数が決まっていて、内側からn番目の殻には最大で2n²個の電子が入るんだ。たとえば、K殻(n=1)には最大2個、L殻(n=2)には最大8個、M殻(n=3)には18個の電子が入ることができるんだよ。




へえ、じゃあ、電子はその殻にどうやって配置されるんですか?



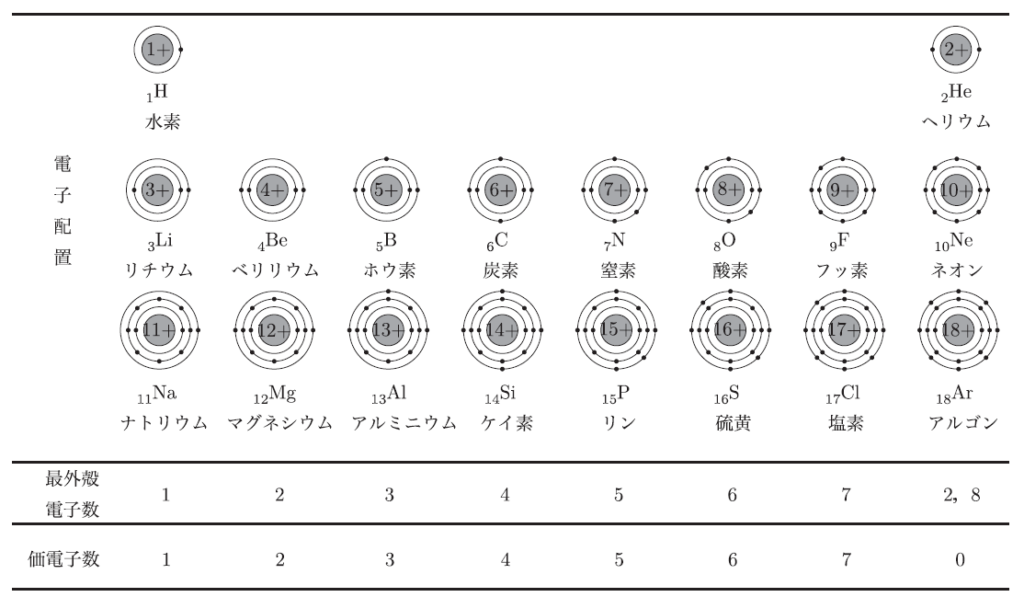
それが電子配置と呼ばれるものなんだ。電子はエネルギーの低い殻から順に詰まっていく。たとえば、ナトリウム原子は11個の電子を持っていて、K殻に2個、L殻に8個、M殻に1個の電子が配置される。こういう配置のことを電子配置と言うんだよ。




最外殻に1個だけ電子があるとどうなるんですか?



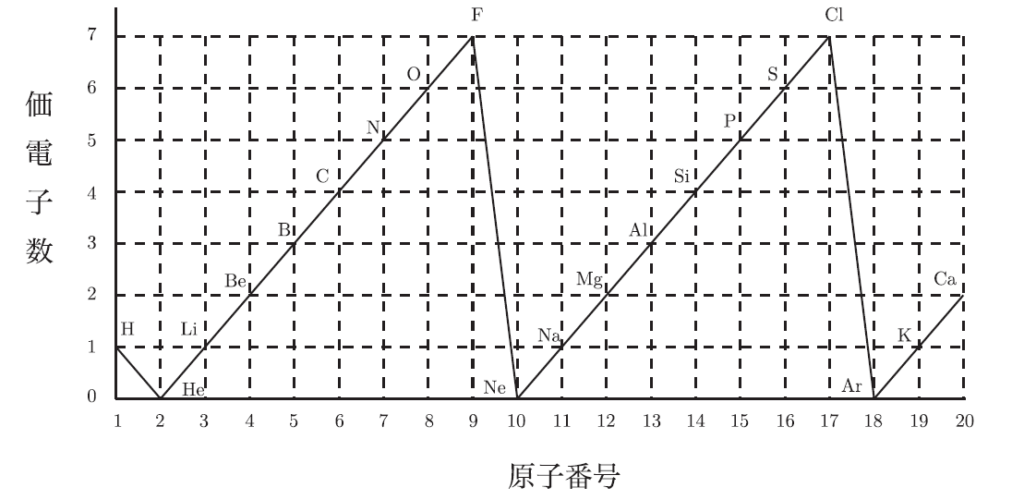
この1個が、他の原子と結びつくときに大きな役割を果たすんだ。特に、最外殻にある電子を価電子と呼んで、この価電子の数がその元素の化学的性質を決定づけるんだ。ただし、希ガスの価電子数は0個となるよ。




なるほど、じゃあ電子がどこにいるかが大事なんですね。



その通りだ。さらに、実際に電子がどこにいるのかは、電子殻よりももっと複雑で、電子軌道という考え方があるんだ。電子は1s軌道や2p軌道といった軌道を通過するとされているよ。しかし、単に軌道上をぐるぐる回るわけではなく、ある確率でその空間のどこかに存在しているんだ。電子がどこにいるかは、量子力学で説明されるけど、これはちょっと難しい話だから、今は「電子は決まった軌道に存在している」ということだけ覚えておけばいいよ。
例題&解答
【例題1】
炭素原子126C の同位体である炭素-14の中性子の数を答えなさい。
【解答】
中性子の数は8個(質量数14-陽子数6)。
【例題2】
ナトリウム原子1123Na の電子配置を答えなさい。
【解答】
電子配置は、K殻に2個、L殻に8個、M殻に1個の電子が配置される。













