このページのまとめ
学習のポイント
- 黄銅鉱に石灰石とコークスを加えて加熱し、還元することで粗銅が得られる。
- 銅は黄銅・青銅・白銅といった様々な合金をつくる。
- 銅はアンモニアと錯イオンを作って溶解し、これをシュヴァイツァー試薬と呼ぶ。
まとめノート

このページでは,銅の性質について解説していきます。銅は原子番号29番の元素で,遷移元素に分類されます。銅のイオンには酸化数が+1のものと+2のものがあり,それぞれで性質が異なります。また,銅は様々な合金をつくることが知られており,それらについて覚えておく必要があります。銅の性質について学習していきましょう。
銅の製法
粗銅の製法

銅は,天然には黄銅鉱として産出することが多いです。黄銅鉱を石灰石・コークスとともに加熱することで,硫化銅(Ⅰ)が得られます。硫化銅(Ⅰ)に空気を吹き込むことで酸化銅(Ⅰ)が生じ,硫化銅(Ⅰ)と酸化銅(Ⅰ)の反応により銅の単体が生じます。ただし,ここで得られた銅は粗銅と呼ばれ,不純物を多く含んでいます。したがって,次に示す電解精錬によって純度を上げなければなりません。
電解精錬
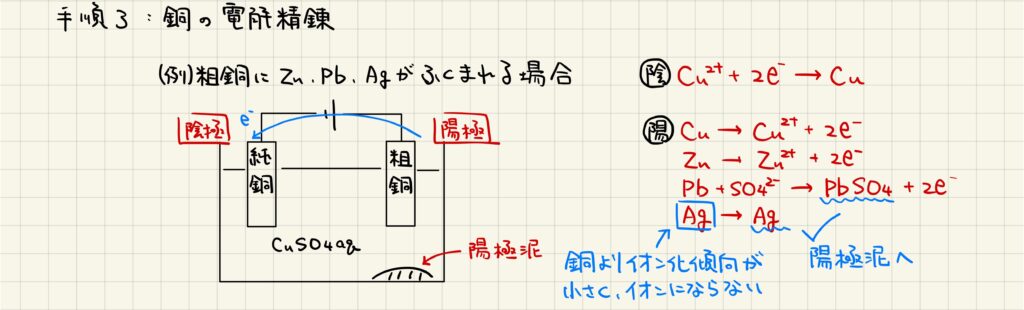
銅の電解精錬では,陽極に粗銅,陰極に純銅をつなぎ,硫酸銅(Ⅱ)水溶液の中で電気分解を行います。例えば,粗銅中に亜鉛,鉛,銀が含まれている場合を考えましょう。電気分解では銅がちょうど反応する電圧で通電するため,銅よりもイオン化傾向が小さい金属のみが酸化されます。すなわち,亜鉛,鉛が酸化され,このうち鉛は硫酸イオンと反応して沈殿を形成します。銀は反応せずに陽極の下に沈殿し,この場合では硫酸鉛と銀は陽極泥と呼ばれます。陰極では銅イオンが還元され,純銅の質量が増加します。
銅の性質
銅を用いた合金
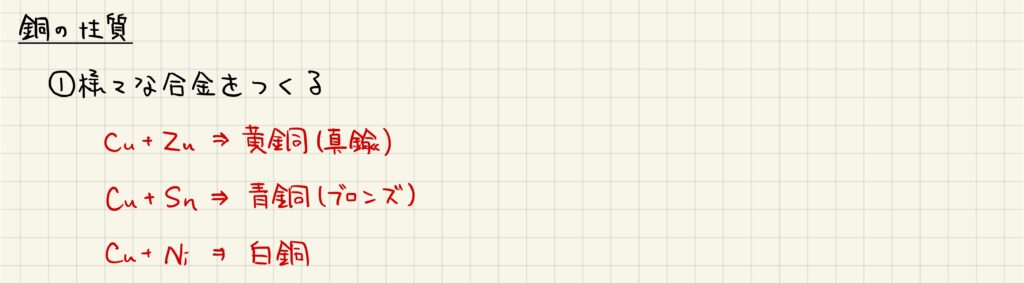
銅に亜鉛を加えた合金は黄銅または真鍮と呼ばれます。また,銅にスズを加えた合金は青銅またはブロンズと呼ばれ,銅にニッケルを加えた合金は白銅と呼ばれます。それぞれの合金について覚えておきましょう。
様々な酸化物をつくる
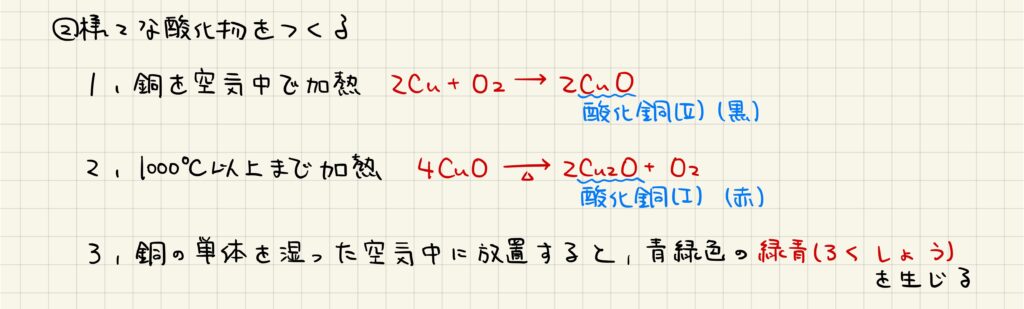
銅を空気中で酸化することで,黒色の酸化銅(Ⅱ)が生じます。ただし,かなり高温で加熱した場合には銅の酸化数が変化し,赤色の酸化銅(Ⅰ)が生じます。この酸化銅(Ⅰ)は,有機化学においてフェーリング反応によって生じる化合物としても知られています。また,銅の単体を湿った空気中に放置すると,青緑色の緑青が生じることが知られています。
銅イオンの生成

銅の単体は酸化力のある酸に対して溶解します。したがって,硝酸と反応して硝酸銅を生じます。また,酸化銅(Ⅱ)は希酸に溶けることが知られています。
銅の錯イオン

銅(Ⅱ)イオンが水に溶けると青色の水溶液を形成し,そこへ塩基を加えると青白色沈殿の水酸化銅(Ⅱ)が生じます。水酸化銅(Ⅱ)は過剰のアンモニアを加えると深青色の錯イオンを形成して再溶解します。また,銅(Ⅱ)イオンとヘキサシアニド鉄(Ⅱ)酸カリウムの反応により,赤褐色沈殿が生じることが知られています。
硫酸銅(Ⅱ)五水和物

銅の単体は酸化力がある酸に溶解するため,熱濃硫酸と反応します。この結果生じた硫酸銅(Ⅱ)無水物は白色粉末ですが,これが水と反応すると青色結晶の硫酸銅(Ⅱ)五水和物が得られます。外見的にわかりやすい変化が生じるため,硫酸銅無水物は水の検出反応に用いられます。