このページのまとめ
学習のポイント
- 赤鉄鉱や磁鉄鉱を還元することで銑鉄が得られ、純度をあげることで鋼となる。
- 鉄は2種類の酸化数をとり、検出反応が異なる。
- 局部電池では、水滴の中心と外縁部がそれぞれ正極・負極の役割を果たしている。
まとめノート
このページでは,鉄の性質について解説していきます。鉄は原子番号26の元素で,遷移元素に分類されます。他の遷移元素と同様に様々な酸化数をとり,酸化物についても複数種類存在しています。検出反応が豊富で,色の変化などが煩雑ですが順番に覚えていきましょう。
鉄の単体の製法
銑鉄の製法
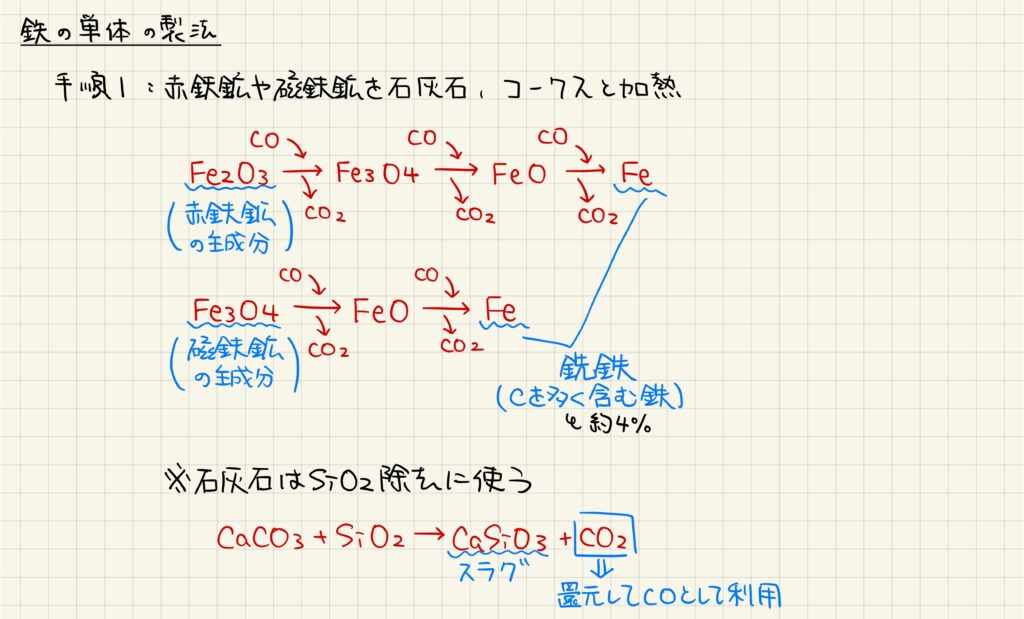
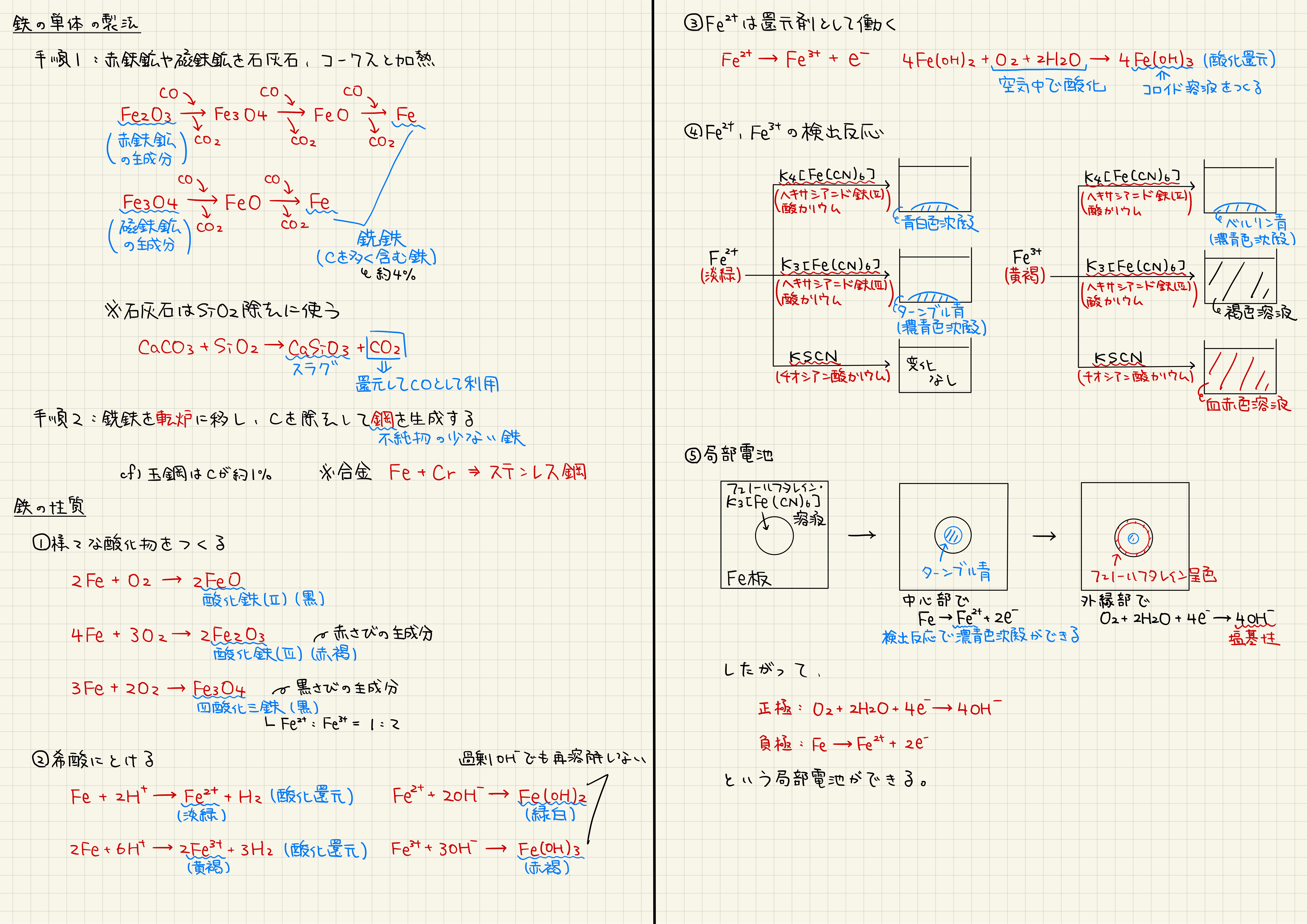
鉄の単体の製法について見ていきましょう。鉄は天然には赤鉄鉱や磁鉄鉱として産出します。これらの鉄を含む鉱石を総称して鉄鉱石と呼びます。赤鉄鉱は酸化鉄(Ⅲ),磁鉄鉱は四酸化三鉄を多く含んでいます。これらの鉱石を石灰石やコークスとともに加熱し,鉄の酸化物を還元していきます。ここで得られた鉄は銑鉄と呼ばれ,不純物として炭素を多く含んでいます。また,石灰石は鉱石に含まれる二酸化ケイ素をスラグとして取り除くために用いられます。
鋼の製法

銑鉄を高温で加熱することで不純物の炭素が取り除かれ,鋼が得られます。鋼は不純物が少なく,硬い建材などに用いられます。日本刀などの材料に用いられる玉鋼は,炭素を約1%含む鉄になります。また,鉄の単体にクロムを加えた合金はステンレス鋼と呼ばれ,錆びにくい性質を示します。
鉄の性質
様々な酸化物をつくる

鉄は様々な酸化数をとり,酸化物の種類も様々です。鉄の単体を空気中で加熱すると,まずは黒色の酸化鉄(Ⅱ)や赤褐色の酸化鉄(Ⅲ)が得られます。ここで酸化鉄(Ⅲ)は赤錆の主成分として知られています。また,他にも黒錆の主成分として黒色の四酸化三鉄があり,ここでは鉄(Ⅱ)イオンと鉄(Ⅲ)イオンが1:2の割合で含まれています。
希酸に溶ける

鉄の単体は希酸に溶けてイオンが生じます。淡緑色の鉄(Ⅱ)イオンは塩基と反応すると緑白色沈殿の水酸化鉄(Ⅱ)が生じます。一方,黄褐色の鉄(Ⅲ)イオンは塩基と反応すると赤褐色沈殿の水酸化鉄(Ⅲ)が生じます。
酸化還元反応を起こす

鉄(Ⅱ)イオンは還元剤として働くことが知られています。同様に水酸化鉄(Ⅱ)は空気中で酸化されると水酸化鉄(Ⅲ)を形成します。水酸化鉄(Ⅲ)は水中で分散してコロイド溶液を形成します。
鉄イオンの検出反応
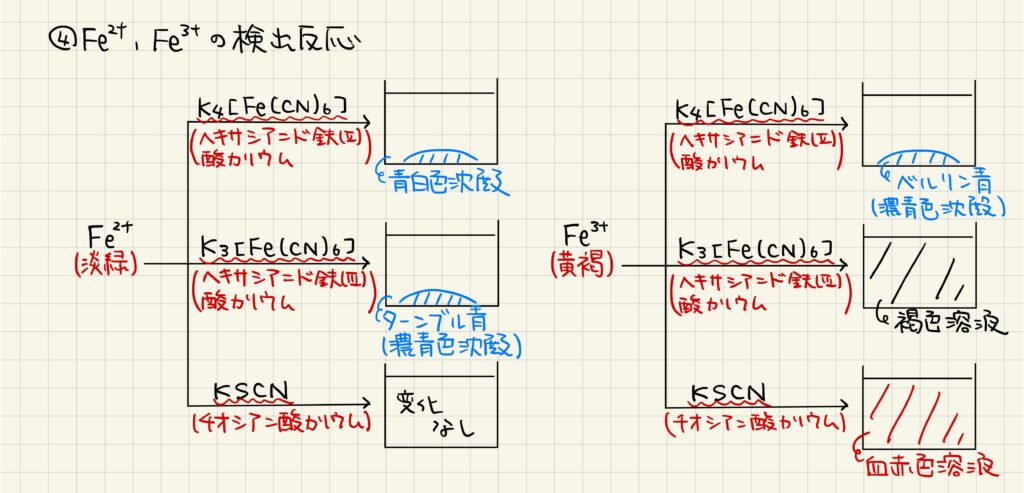
鉄イオンの検出反応は数多く知られています。淡緑色の鉄(Ⅱ)イオンに対してヘキサシアニド鉄(Ⅱ)酸カリウムを加えた場合は,青白色沈殿が得られます。また,鉄(Ⅱ)イオンに対してヘキサシアニド鉄(Ⅲ)酸カリウムを加えた場合はターンブル青と呼ばれる濃青色沈殿が得られます。最後に,チオシアン酸カリウムとは特に反応しません。
一方,黄褐色の鉄(Ⅲ)イオンはヘキサシアニド鉄(Ⅱ)酸イオンを加えるとベルリン青と呼ばれる濃青色沈殿が得られます。また,ヘキサシアニド鉄(Ⅲ)酸カリウムを加えた場合は褐色溶液になります。最後に,チオシアン酸カリウムを加えた場合は血赤色溶液になることが知られています。
局部電池
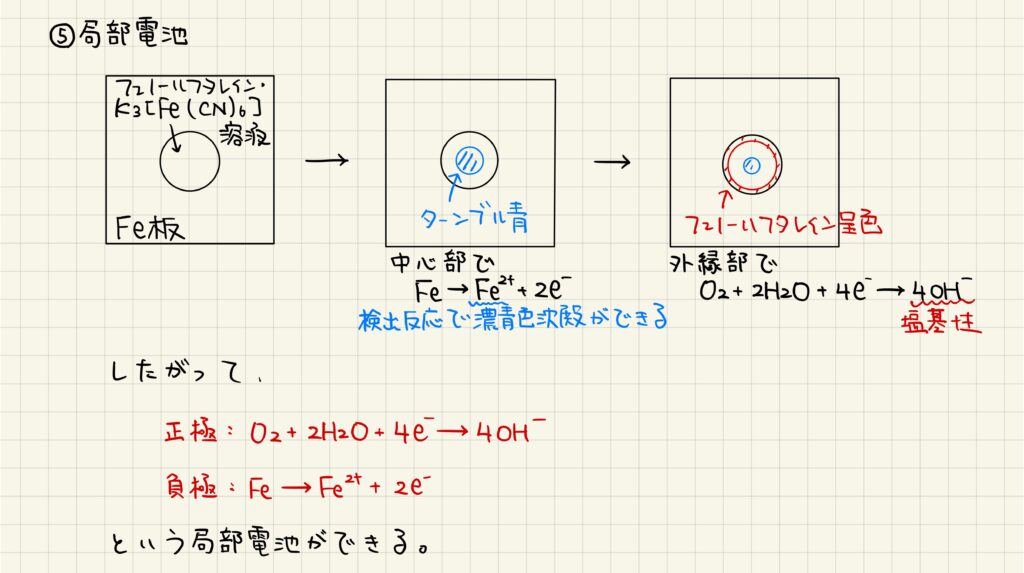
鉄を用いた局部電池が知られています。鉄板の上に水滴を滴下し,そこへフェノールフタレインとヘキサシアニド鉄(Ⅲ)酸カリウムを加えます。中心部では鉄板が酸化されて鉄(Ⅱ)イオンが生じ,ヘキサシアニド鉄(Ⅲ)酸カリウムと反応して濃青色沈殿ができます。また,外縁部では空気中の酸素が還元されて塩基性になり,フェノールフタレインが赤色に呈色します。この一連の反応は水滴内で酸化反応と還元反応が別々に起きているので,局部電池と呼ばれます。