このページのまとめ
学習のポイント
- 遷移元素は元素周期表の第3族から第11族に分類される元素で、反応性が似ている金属元素である。
- 遷移元素は複数の酸化数をとり、多様な化合物を形成する。
- 遷移元素は錯イオンを形成して水溶液中で様々な色を示す。
- 錯イオンとは、金属イオンに配位子が結合してできるイオンである。
まとめノート
このページでは,遷移元素の性質や錯イオンについて解説していきます。元素周期表において元素は典型元素と遷移元素に分けられます。遷移元素は典型元素とは異なる性質を示すので,別で性質を覚えておきましょう。遷移元素の性質として,錯イオンを形成するというものがあります。錯イオンの形成や名前について学習していきましょう。
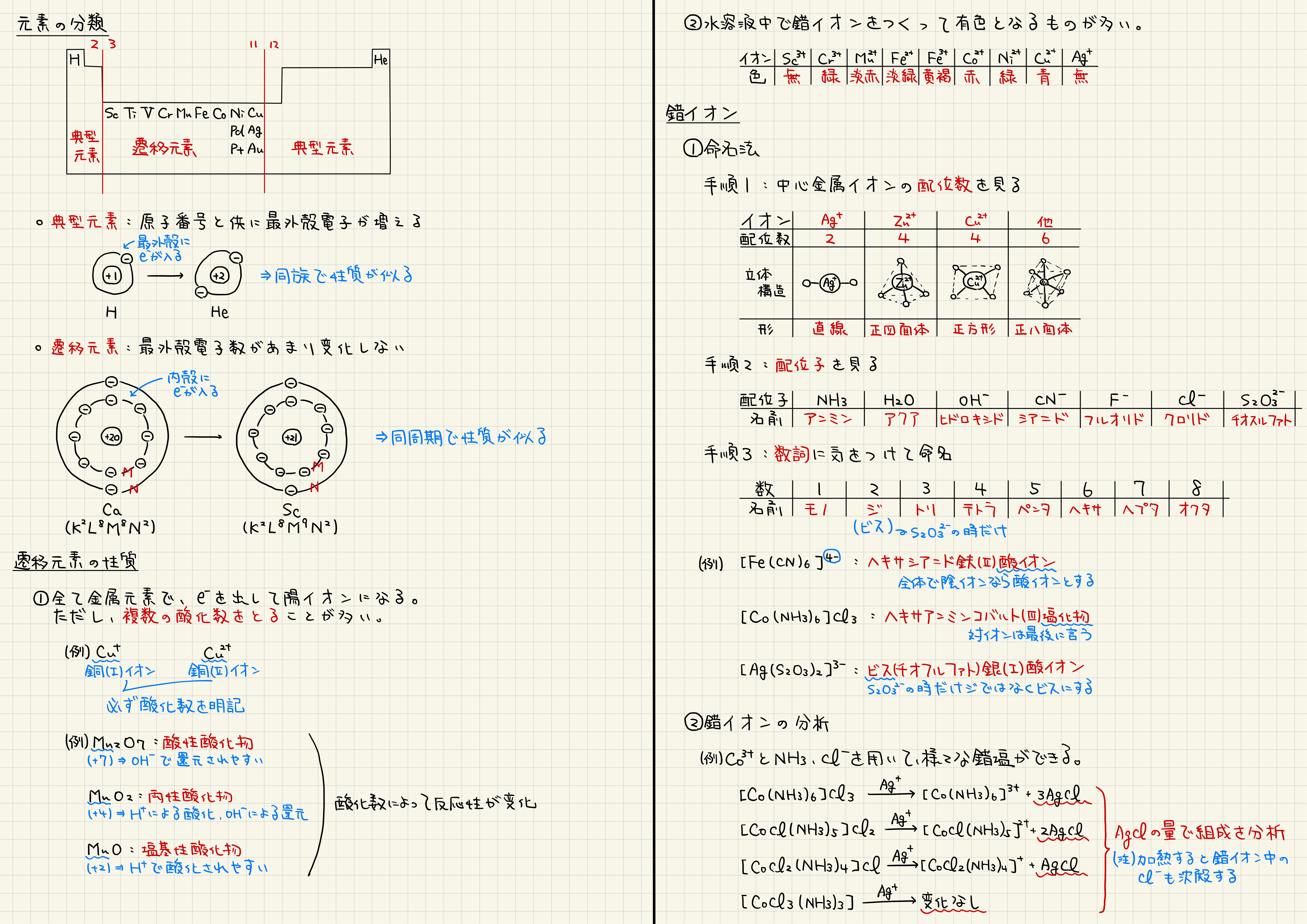
元素の分類
元素周期表で見る
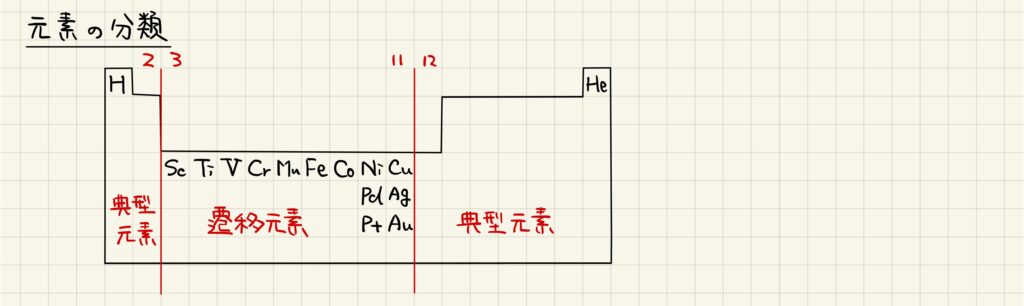
元素周期表において,元素は典型元素と遷移元素に分類されます。典型元素とは,第1,2および12~18族(新課程では1,2,13~18族)に分類される元素です。一方,遷移元素とは,典型元素以外の元素を指します。典型元素と遷移元素では性質が異なるので,それぞれ性質を確認していきましょう。
典型元素と遷移元素
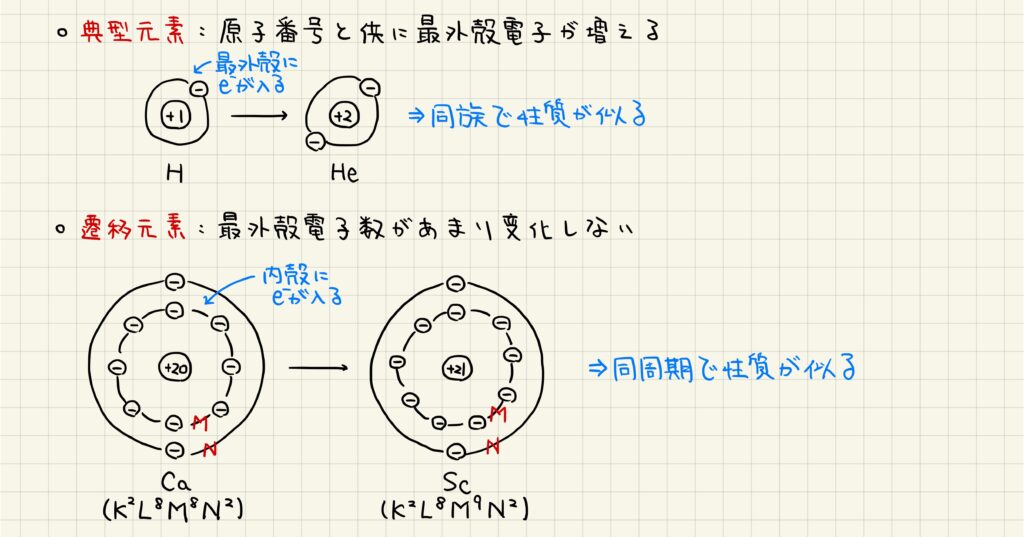
典型元素は,原子番号が増加するにしたがって最外殻の電子が増加していきます。そのため,典型元素は同族で価電子数が同じで,性質が似ています。一方,遷移元素では原子番号が増加しても最外殻の電子が変化しないことが多いです。そのため,遷移元素は同周期で価電子数および原子半径が等しいために性質が似ています。
遷移元素の性質
様々な酸化数をとる

イオンになる際に内殻の電子も放出することができるため,遷移元素は複数種類のイオンを形成します。例えば銅は,一価と二価の陽イオンをつくることが知られています。また,遷移元素は複数の酸化数をとることが知られています。そのため,同じ元素の酸化数でも反応性が異なります。例えば,マンガンの酸化物は酸性酸化物・両性酸化物・塩基性酸化物がそれぞれ存在しています。
様々な色のイオンを形成する

遷移元素のイオンは水中で錯イオンを形成し,有色なものが多いです。表で示されている色は,それぞれのイオンがアクア錯イオンを形成した際の色です。これらの色については覚えておきましょう。
錯イオン
錯イオンの命名法
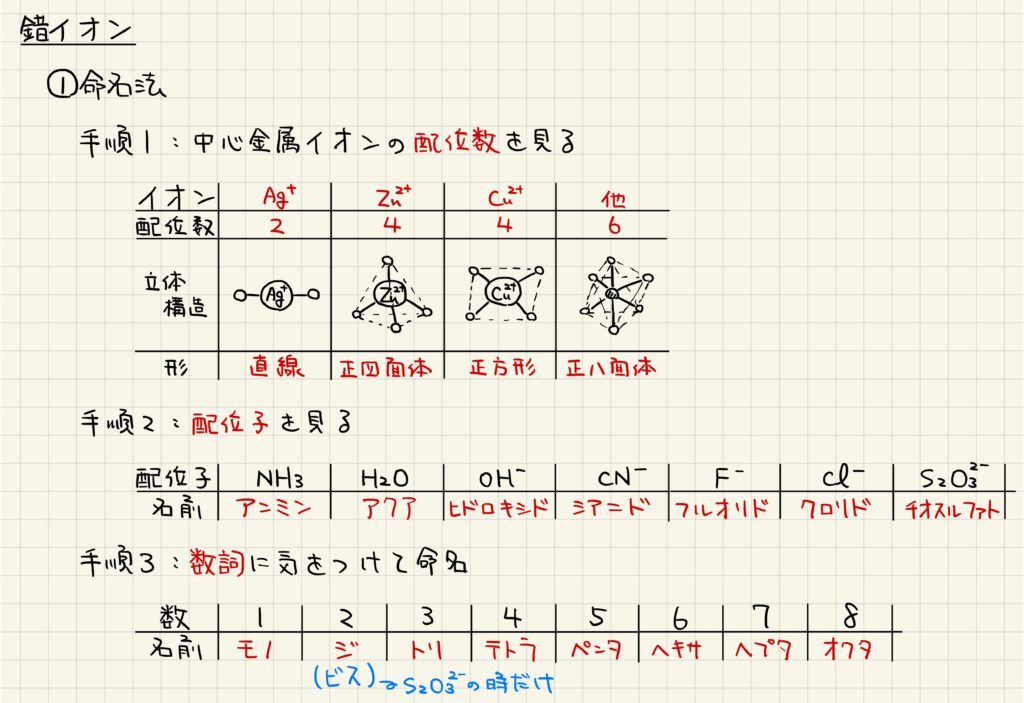
錯イオンの名前について学習していきましょう。まずは錯イオンを形成している中心の金属イオンを確認します。金属イオンによって配位数が決まっており,銀イオンが二配位,亜鉛および銅が四配位,その他のイオンは六配位となります。この時,亜鉛は正四面体型,銅は正方形型の錯イオンを形成することが知られています。
次に,配位結合をしている配位子を確認していきます。頻出なのはアンミン,アクア,ヒドロキシドなどです。最後に,こうした配位子の配位数を確認して,錯イオンを命名します。
錯イオンの例

先述した命名法にしたがって,錯イオンの名前を考えてみましょう。ヘキサシアニド鉄(Ⅱ)酸イオンにみられるように,全体として陰イオンになっているものは酸イオンと呼びます。また,ヘキサアンミンコバルト(Ⅲ)塩化物にみられるように,錯塩を形成している場合は対イオンを最後に述べます。また,ビス(チオスルファト)銀(Ⅰ)酸イオンは例外的な命名となるので,個別に覚えておきましょう。
錯イオンの分析

錯イオンの組成を分析する際は,沈殿を生成します。例えばコバルトとアンモニア・塩化物イオンの錯イオンは,銀イオンを加えて塩化銀がどれだけ沈殿するかで組成式を判断することができます。常温で銀イオンを加えると,錯イオン中の塩化物イオンは沈殿せず,錯イオンの対イオンとして結合している塩化物イオンのみ沈殿します。ただし,加熱しながら銀イオンを加えると錯イオン中の塩化物イオンも沈殿するので覚えておきましょう。