このページのまとめ
学習のポイント
- 気体の製法を考える際には、反応物の状態と加熱の有無によって実験器具が異なる。
- 加熱が必要な場合は、熱分解・熱濃硫酸の反応・固体どうしの反応・吸熱反応の4種類。
- 乾燥剤は、酸性乾燥剤・中性乾燥剤・塩基性乾燥剤が存在し、それぞれ乾燥できない気体がある。
- 気体の捕集は、水上置換・上方置換・下方置換のいずれかで行われる。
まとめノート
このページでは,気体の製法について解説しています。ここまで非金属元素を学習してきましたが,これらの元素からなる物質は融点や沸点が低く,常温で気体のものが多く存在します。気体を生成するために用いられる反応物や,乾燥剤・捕集法について学習していきましょう。
気体の製法
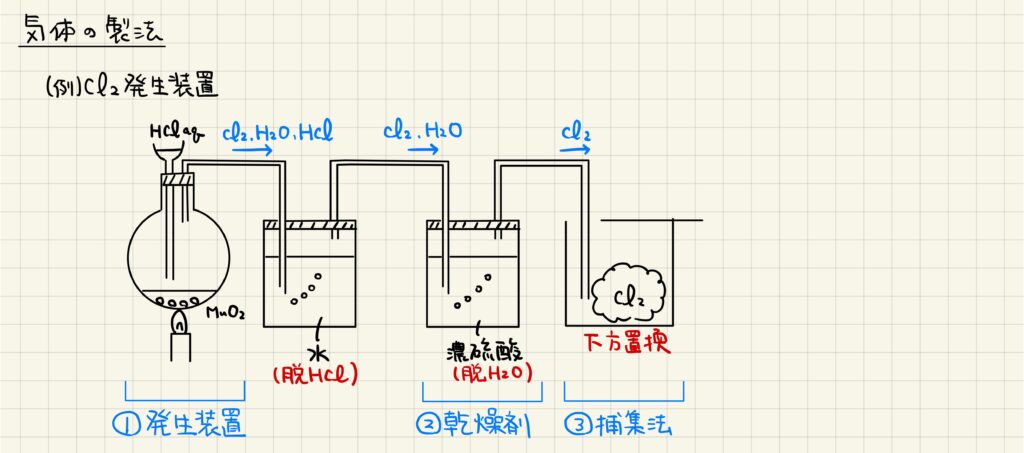
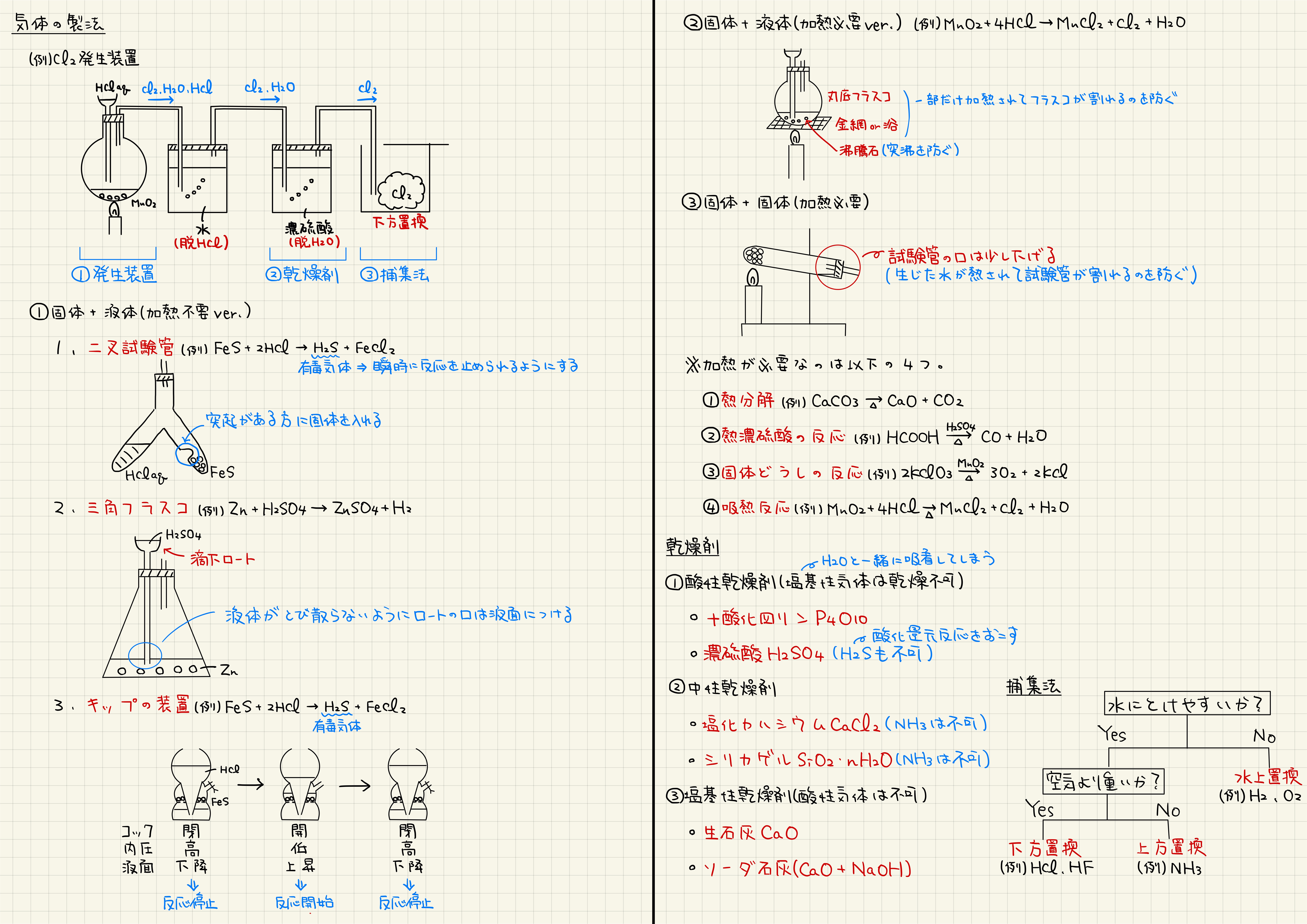
無機化学の範囲では,実験装置のを問う問題が出題されます。気体の製法では,大きく分けて①発生装置,②乾燥剤,③捕集法の3つの部分に分けて考えることができます。例えば塩素の製法では,濃塩酸と二酸化マンガンを加えて加熱することで,気体を発生させます。しかし,このままでは不純物として塩化水素や水蒸気を含んでいるので,水に通して塩化水素を除き,濃硫酸に通して水蒸気を取り除きます。最後に純粋な塩素を下方置換で捕集します。
固体+液体(加熱不要Ver.)

二叉試験管は,片方に突起が設けられています。突起がある方に固体を入れ,他方に液体の反応物を入れます。試験管を固体側に傾けることで反応が開始し,必要量の気体が得られた時に反対側に傾けることで固体と液体が分離し,速やかに反応が止まります。硫化水素のような危険な気体を発生させるときに用いられることが多いです。

三角フラスコは,固体と液体で反応させる際に用いる一般的な器具です。ただし,液体が飛び散らないように滴下ロートの足は液面につけておくことが望ましいです。
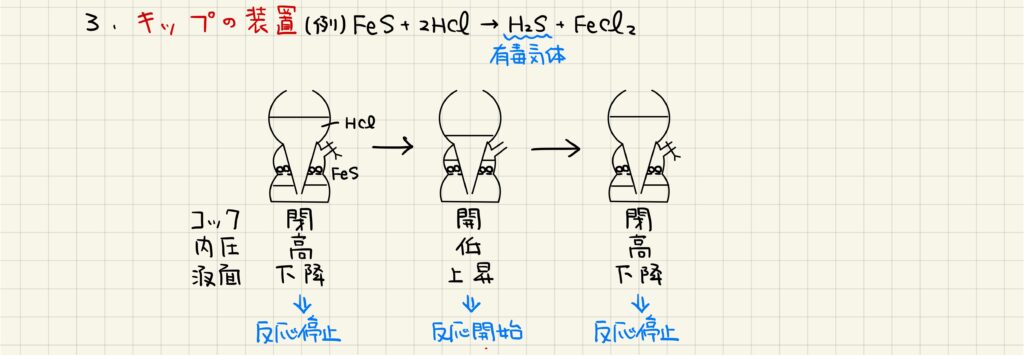
キップの装置は,2つのガラス器具が組み合わさってできた装置です。コックが閉じている時には内圧が高いため液体反応物の液面が下がっており,反応は起こりません。コックを開けることで内圧が下がり,液面が上がってくることで反応が開始します。必要量の気体が得られればコックを締めることで内圧が上がり,反応が停止します。すなわち,コックが空いている時だけ反応が進行することになります。
固体+液体(加熱必要Ver.)

固体と液体の反応でも,加熱が必要な場合があります。この場合には丸底フラスコを用い,金網や浴を介して加熱していきます。丸底フラスコや金網・浴は熱が一部に集中してガラス器具が割れるのを防ぐ役割があります。
固体+固体
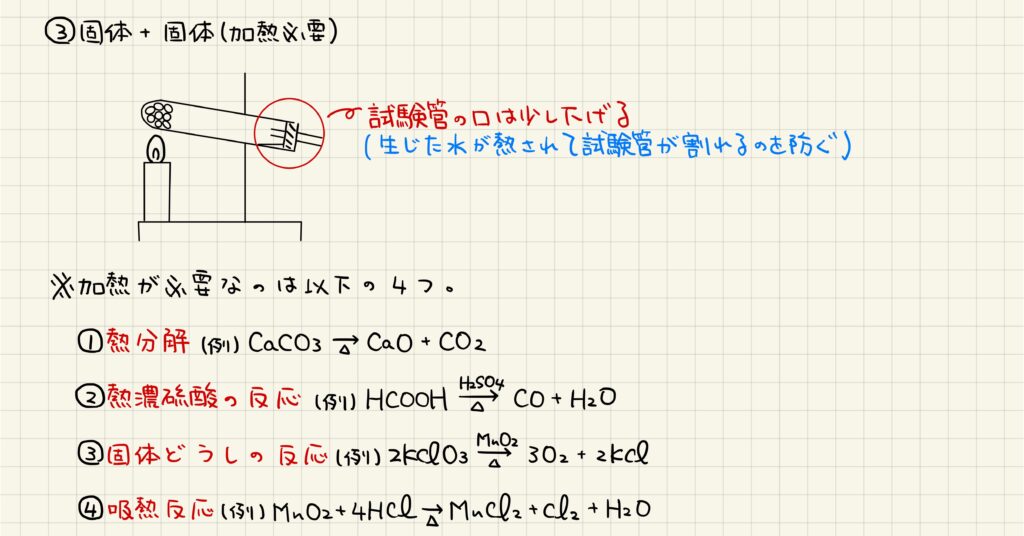
固体と固体が反応する場合には,接触面が少ないために反応が遅くなりがちです。そのため,基本的に加熱が必要となります。試験管の中に反応物を詰め,試験管の口は少し下げて加熱を行います。これは,反応によって生じた水が加熱されて試験管が割れるのを防ぐためです。
加熱の有無で実験器具が変わりますが,加熱が必要なのは上記の通りです。いずれの反応も,常温では反応速度がかなり遅いため,加熱をすることで速やかに反応を進行させています。
乾燥剤・気体の捕集法

乾燥剤は,①酸性乾燥剤,②中性乾燥剤,③塩基性乾燥剤の3つに分類することができます。乾燥とは,目的の気体と水蒸気とを分離する操作ですので,目的の物質が乾燥剤と反応してはいけません。その理由で,酸性乾燥剤は塩基性気体は乾燥できませんし,塩基性乾燥剤は酸性気体を乾燥できません。その他にも,酸化還元反応を起こしてしまうために濃硫酸は硫化水素を乾燥することができません。
気体の捕集法は,①水上置換,②下方置換,③上方置換の3つに分類することができます。水に溶けにくい気体は水上置換で捕集することが望ましいですが,水に溶けやすい気体は下方置換または上方置換で捕集することになります。高校化学の範囲では,上方置換で捕集するのはアンモニアのみとなりますから,覚えておきましょう。