このページのまとめ
学習のポイント
- 炭素は同素体を複数持ち、ダイヤモンドや黒鉛がよく知られている。
- フラーレンは分子式C60で表される物質で、超伝導性が期待されている。
- 一酸化炭素はギ酸やシュウ酸の脱水によって得られ、無色無臭で有毒な気体である。
- 二酸化炭素は炭酸カルシウムの弱酸遊離によって得られ、石灰水に通じると白濁する。
まとめノート

このページでは,炭素の性質について解説していきます。炭素は元素周期表で第14族第2周期に属する元素で,原子番号は6番です。単体には同素体があり,様々な性質が知られています。化合物では一酸化炭素や二酸化炭素が代表的で,いずれも炭素の単体が酸化された物質となっています。
炭素の単体
ダイヤモンド・黒鉛
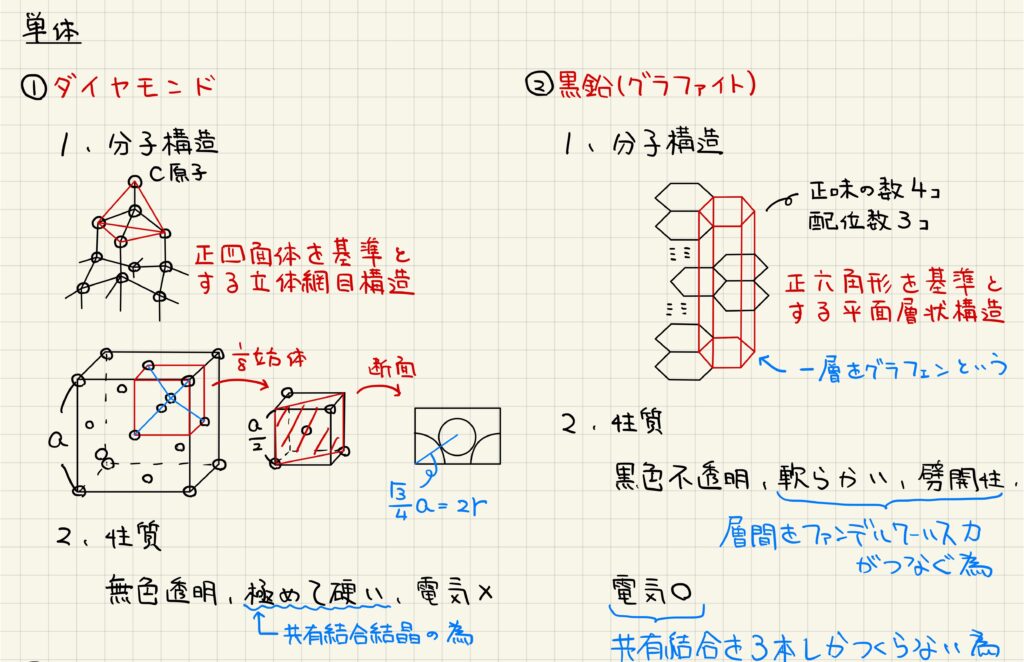
炭素の単体には,同素体が存在します。最も有名なのは,ダイヤモンドと黒鉛です。ダイヤモンドは炭素原子が正四面体を基準とした立体網目構造を形成しています。無色透明で,極めて硬いことが知られています。また,電気を通すことはありません。
黒鉛(グラファイト)は,炭素原子が正六角形を基準とする平面層状構造を形成しています。一層をグラフェンと呼び,グラフェンどうしががファンデルワールス力によって結合しています。黒鉛は黒色不透明で,ファンデルワールス力が弱い力のため,柔らかく,劈開性があります。また,原子あたりに共有結合を3本だけ形成するので,余った電子によって電気を通じます。
フラーレン

炭素の同素体として,フラーレンがあります。フラーレンは分子式C60で表される物質で,炭素原子がサッカーボール状に配列しています。フラーレンには,超電導性があることが報告されています。
フラーレンに含まれる五角形・六角形・単結合・二重結合の数を数える問題が頻出です。互いに独立しているので,五角形は12個存在していることが分かります。五角形は全て単結合であり,単結合は60本となります。全結合が120本であることから,二重結合が30本であることが計算できます。最後に,六角形1つあたりに二重結合が 正味1.5本あるので,六角形は20個と分かります。
一酸化炭素
製法

一酸化炭素は,ギ酸やシュウ酸を脱水することで生成されます。脱水剤として濃硫酸を用いることが多いです。また,工業的には加熱したコークスに水蒸気を加えることで,水素と一酸化炭素が得られます。水素と一酸化炭素の混合物を水性ガスと呼びます。
性質

一酸化炭素は,無色無臭の有毒気体です。一酸化炭素は,赤血球に含まれるヘモグロビンと結合して機能を低下させるため,有毒とされています。この状態を一酸化炭素中毒と言います。
一酸化炭素は空気中で青色の炎を上げて燃焼し,二酸化炭素が生じます。また,一酸化炭素は還元性があり,金属の単体を得る反応などに用いられています。
二酸化炭素
製法

二酸化炭素は二価の弱酸で,炭酸カルシウムを用いた弱酸遊離により生成します。ただし,強酸は希塩酸を用いなければなりません。これは,希硫酸を使うと炭酸カルシウムの表面に水に不溶な硫酸カルシウムが覆い,反応が進行しなくなるためです。
性質

石灰水に二酸化炭素を通じることで,水溶液が白濁します。これは,水に不溶な炭酸カルシウムが生成されるためです。この白濁した水溶液に二酸化炭素を通じ続けると,炭酸カルシウムが炭酸水素カルシウムになって再溶解し,透明な水溶液になります。
二酸化炭素は無色無臭・少量であれば無毒な気体で,大気中に微量含まれています。また,二酸化炭素は昇華性を持ち,固体はドライアイスと呼ばれます。