このページのまとめ
学習のポイント
- 硫黄は様々な酸化数をとり、単体の他に多様な化合物を形成する。
- 硫黄の単体には斜方硫黄、単射硫黄、ゴム状硫黄という同素体が存在する。
- 硫化水素は硫化鉄(Ⅱ)に希塩酸を加えることで生成される。
- 硫化水素は腐卵臭のある気体で、還元剤として働く他、様々な金属イオンと硫化物沈殿を形成する。
- 硫酸は工業的には接触法により生成される。
まとめノート
今回は,硫黄の性質について解説します。硫黄の単体は同素体をもち,様々に異なる性質を示します。また,化合物では硫化水素,二酸化硫黄,硫酸などが知られています。それぞれの化合物について製法や性質を確認していきましょう。
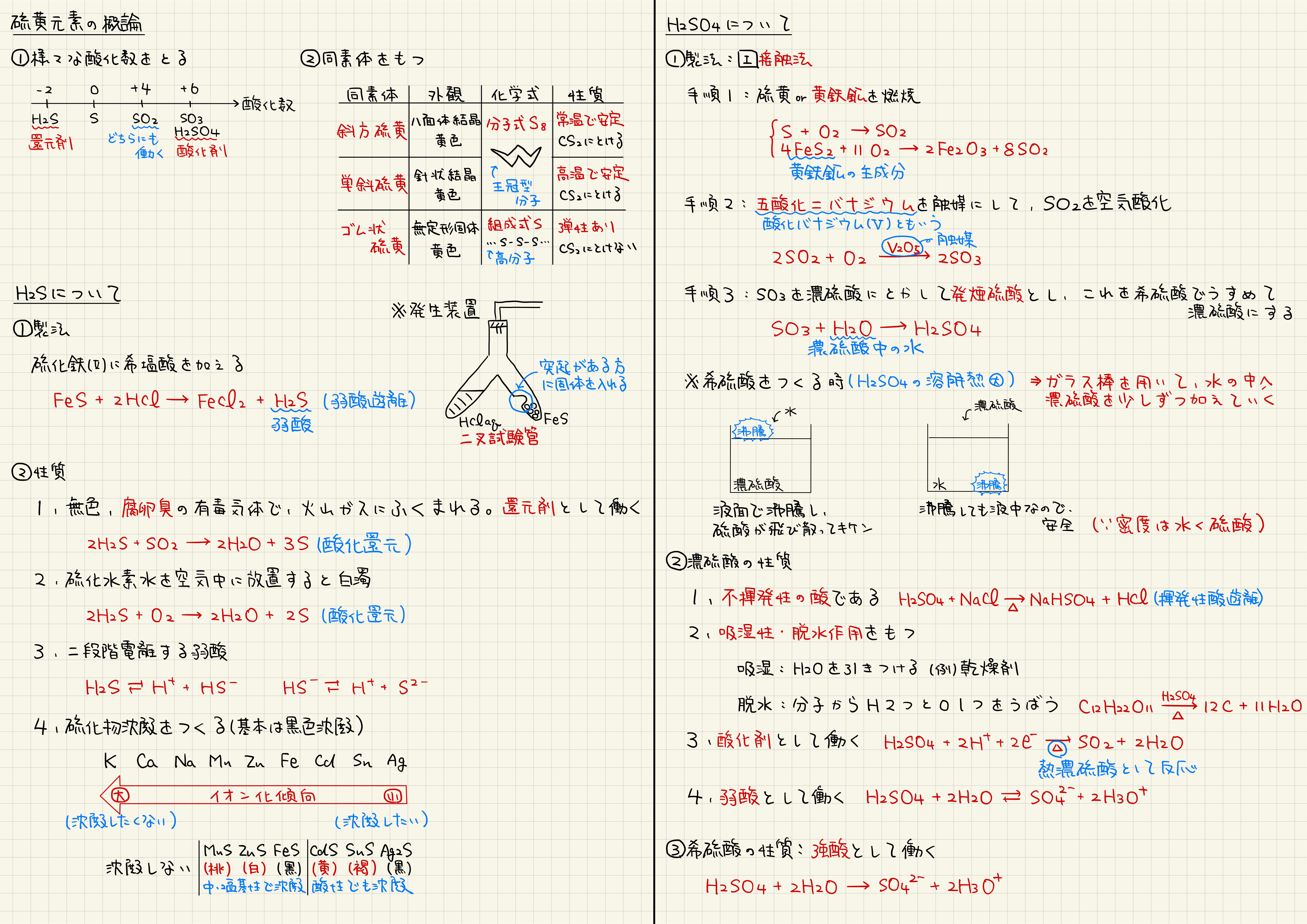
硫黄元素の概論
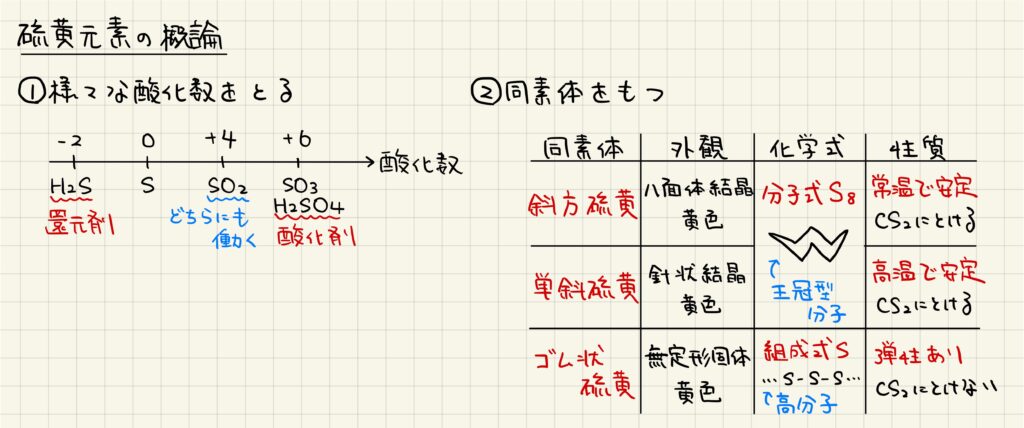
硫黄は,様々な酸化数を取ることが知られています。酸化数が小さい硫化水素は還元剤として働き,逆に酸化数が大きい三酸化硫黄や硫酸は酸化剤として働きます。こうした理屈から,二酸化硫黄が酸化剤としても還元剤としても働くことが理解できるでしょう。
また,硫黄の単体は同素体をもちます。同素体としては,斜方硫黄,単射硫黄,ゴム状硫黄を覚えておきましょう。斜方硫黄と単射硫黄は分子式S8で表される王冠状分子で,分子の配列によって異なる物質を形成しています。斜方硫黄が常温で安定,単射硫黄は高温で安定な構造になります。ゴム状硫黄は高分子で,弾性があります。
硫化水素について
製法

硫化水素は,硫化鉄(Ⅱ)に希塩酸を加えることによって生成します。硫化水素は弱酸ですから,弱酸遊離によって反応が進行していきます。また,この時,二叉試験管を用いる場合があります。二叉試験管では,突起がある方に固体を入れることで,反応を速やかに停止させることができます。
性質

硫化水素は火山ガスに多く含まれる有毒気体で,腐乱臭があります。還元剤として働くため,二酸化硫黄や酸素と酸化還元反応を起こします。また,弱酸としても働き,水中で電離して水素イオンを生じます。電離によって生じた硫化物イオンは硫化物沈殿をつくります。硫化物沈殿は基本的に黒色ですが,MnSが桃色,ZnSが白色,CdSが黄色,SnSが褐色という例外を含みます。
硫酸について
製法

硫酸は,工業的には接触法によって生成します。初めに硫黄の単体または黄鉄鉱(硫化鉄(Ⅱ)が主成分)を燃焼させて,二酸化硫黄を得ます。次に,五酸化二バナジウムを触媒として,二酸化硫黄を空気酸化して三酸化硫黄を得ます。最後に三酸化硫黄を濃硫酸に溶かすことで発煙硫酸とし,これを希硫酸で薄めて濃硫酸を生成します。全体として,硫黄を少しずつ酸化していく工程になっています。
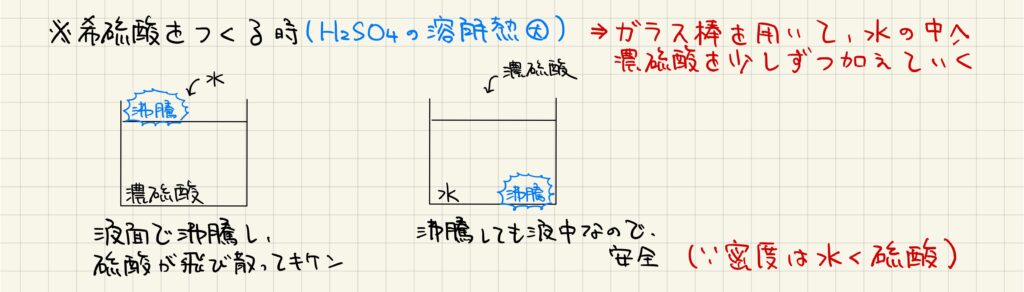
接触法では濃硫酸を生成できますが,希硫酸を生成する際には水に濃硫酸を加えて希薄させます。ただし,ここで濃硫酸に水を加えてしまうと,濃硫酸の表面で水が沸騰してしまい,硫酸が飛び散って危険です。これは,硫酸の水に対する溶解熱が大きく,密度は水よりも硫酸が大きいことに起因しています。以上の理由から,硫酸の希薄は慎重に行わなければなりません。
濃硫酸の性質

濃硫酸には,様々な性質が知られています。まず,濃硫酸は不揮発性の酸です。この性質を利用して,揮発性酸の遊離によって塩化水素などを生成することができます。次に,濃硫酸は吸湿性,脱水作用をもちます。言葉が似ていますが,吸湿とは水分子を吸着するだけであるのに対して,脱水とは水分子を生成する化学反応です。ショ糖に濃硫酸を加えて黒変する反応は,この脱水作用によるものです。
濃硫酸は,酸化剤として働くことが知られています。ただし,硫酸が酸化剤として働くのは加熱を伴った熱濃硫酸の場合だけであることに注意しておきましょう。最後に,濃硫酸は弱酸として働きます。硫酸というと強酸のイメージがありますが,濃硫酸では水が少なく電離が進みづらいため,弱酸として扱われます。
希硫酸の性質
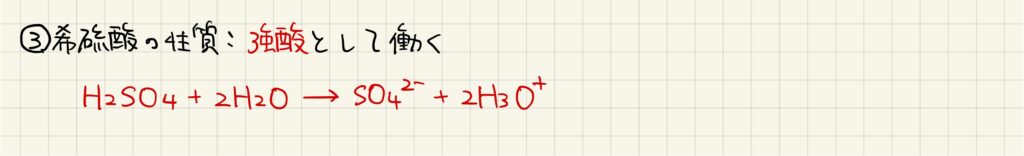
濃硫酸は弱酸として扱われましたが,希硫酸は強酸として扱います。二段階で電離して水素イオンを生成することが知られています。