このページのまとめ
学習のポイント
- 酸素は第16族第2周期に属する元素で、地殻中に最も多く含まれる。
- 酸素には同素体が存在し、オゾンは淡青色の有毒気体で、酸化力があり、殺菌・漂白作用を示す。
- 酸素分子は過酸化水素水に二酸化マンガンを加えるか、塩素酸カリウムに二酸化マンガンを加えて加熱することで得られる。
まとめノート

このページでは,酸素の性質について解説していきます。酸素は原子番号8番,元素周期表では第16族第2周期に位置する元素です。酸化物を作るほか,単体としては酸素とオゾンという2種類の同素体をつくります。これらの物質について,製法や性質を学んでいきましょう。
酸素元素の概論

酸素元素について概説していきます。酸素原子は8個の電子をもち,K殻に2個,L殻に6個位置しています。あと2個の電子を得ることで最外電子殻がオクテット(閉殻)になるため,2価の陰イオンになりやすいです。電気陰性度はFに次いで2番目に大きく,取りうる酸化数は-2,-1,0のみです。一般的な酸化物では酸素の酸化数は-2であり,単体では酸化数が0となります。唯一,過酸化水素H2O2は酸素の酸化数が-1となるので注意が必要です。
クラーク数

クラーク数とは,地殻中に含まれる元素の割合です。酸素原子は酸化物の形で多く存在しているため,クラーク数が最も大きくなっています。尚,大気中では窒素分子が約78%,酸素原子が約21%,アルゴンが約1%を占めることも合わせて覚えておきましょう。
酸化物の分類
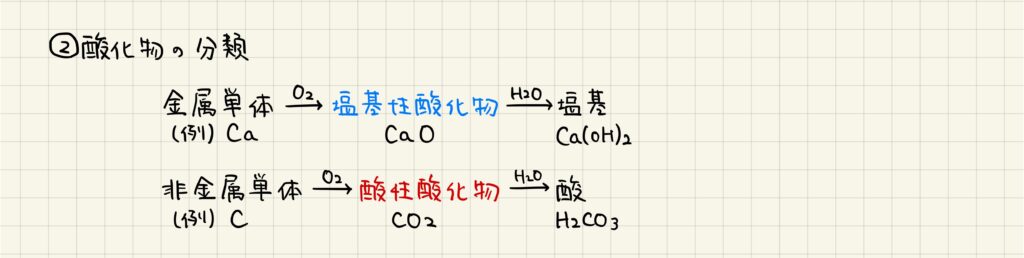
酸素は他の原子と結合して酸化物をつくります。その際,金属の原子と結合すると塩基性酸化物,非金属の原子と結合すると酸性酸化物を生成します。例えば,金属のカルシウムは酸化カルシウムをつくりますが,これが水と反応すると強塩基として有名な水酸化カルシウムをつくります。一方,非金属の炭素は二酸化炭素をつくり,これが水と反応すると弱酸の炭酸をつくります。
酸素の同素体
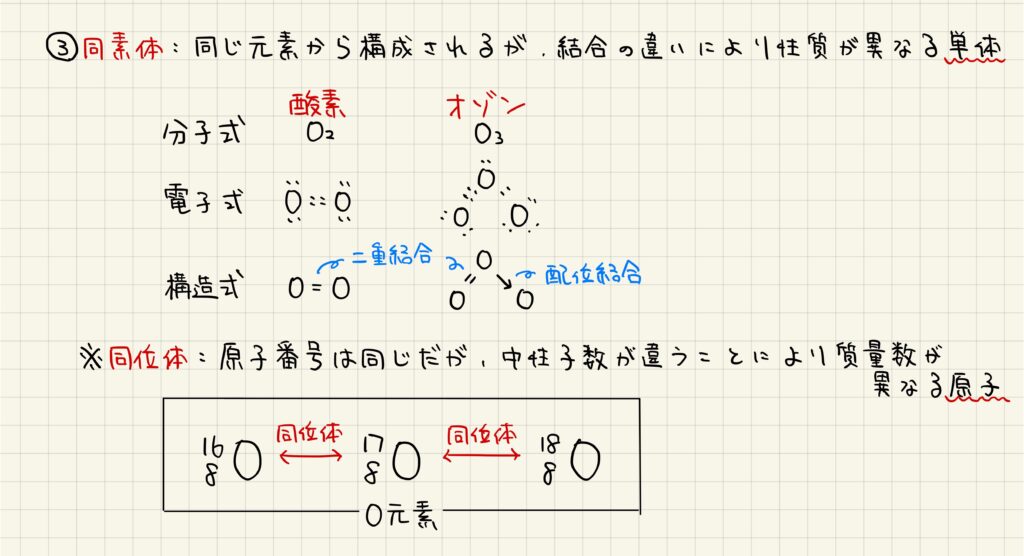
酸素は,2種類の同素体を形成します。ここで同素体とは,同じ元素から構成されるが,結合の違いにより性質が異なる単体を指します。酸素の同素体は,酸素O2とオゾンO3です。それぞれの分子式,電子式,構造式は覚えておきましょう。
また,同素体と間違いやすい言葉として,同位体があります。同位体とは,原子番号は同じだが,中性子数が違うために質量数が異なる原子です。同素体との定義の違いに注目しておきましょう。
O2について
製法
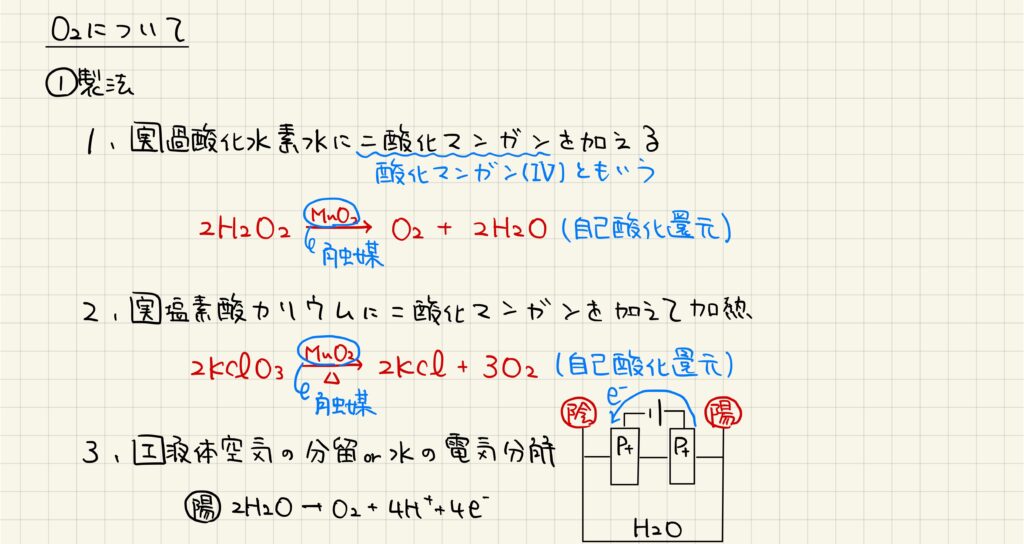
酸素分子は,実験室では過酸化水素水に二酸化マンガンを加えることで生成します。この反応において二酸化マンガンは触媒として働いていることを覚えておきましょう。また,酸素分子は塩素酸カリウムに二酸化マンガンを加えて加熱することでも得られます。この反応でも二酸化マンガンは触媒の働きをします。一方,酸素分子は工業的には液体空気の分留や水の電気分解によって生成します。
性質

酸素分子の性質として,助燃性があります。酸素原子と反応することにより,燃焼反応が起こります。また,酸素分子は酸化剤として働くことも覚えておきましょう。
O3について
製法

オゾンは,気体の酸素中で無声放電をするか,紫外線を当てることで生成できます。無声放電とは,酸素中に高電圧で電流を流す操作を指します。何れにしても,強いエネルギーを加えることで原子どうしの結合を組み替えてオゾン分子をつくっています。
性質

オゾンは淡青色で特異臭をもつ有毒気体です。酸化剤として働き,殺菌・漂白作用を示すことが知られています。オゾンは酸化剤としての性質があるため,湿らせたヨウ化カリウムデンプン紙にオゾンを触れさせると,ヨウ素が生成し,ヨウ素デンプン反応により青色に呈色します。