このページのまとめ
学習のポイント
- ハロゲン化水素は酸として働くが、HFは弱酸、それ以外は原子番号が大きいほど強い酸になる。
- ハロゲン化水素が還元剤として働く場合は、原子番号が大きいほど還元力が強くなる。
- フッ化水素は、ホタル石に濃硫酸を加えて加熱することで得られる。
- ハロゲン化銀は感光性をもち、光を当てると銀の単体が析出する。
まとめノート
このページでは,ハロゲンの化合物について解説します。ハロゲンの化合物として覚えておきたいのはハロゲン化水素およびハロゲン化銀です。ハロゲン化水素は酸として反応したり,また,還元剤としても反応します。ハロゲン化銀はAgFを除いて水に不溶であり,沈殿として生成します。それらの沈殿がどのように反応するのか,確認していきましょう。
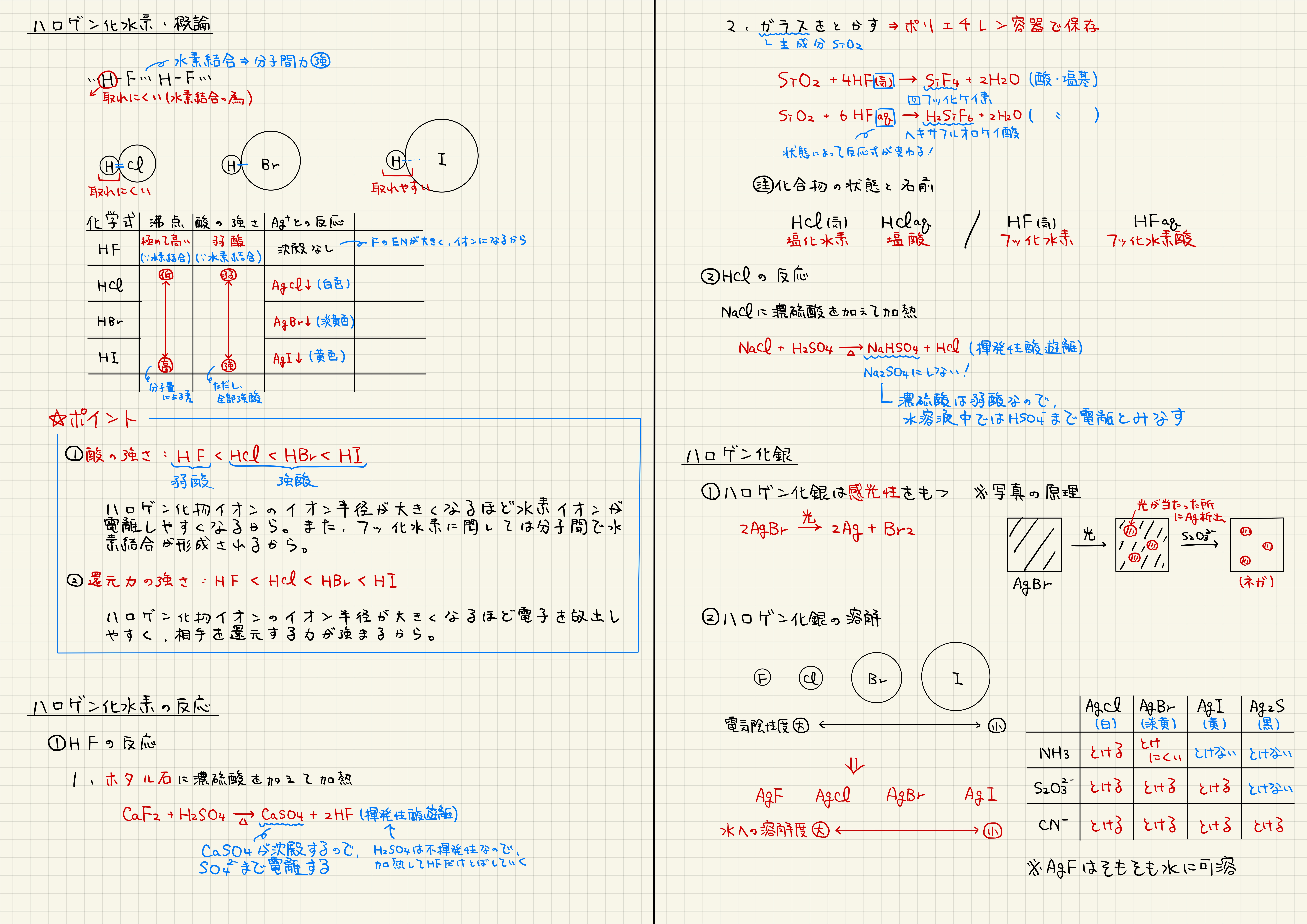
【ハロゲン化水素・概論】
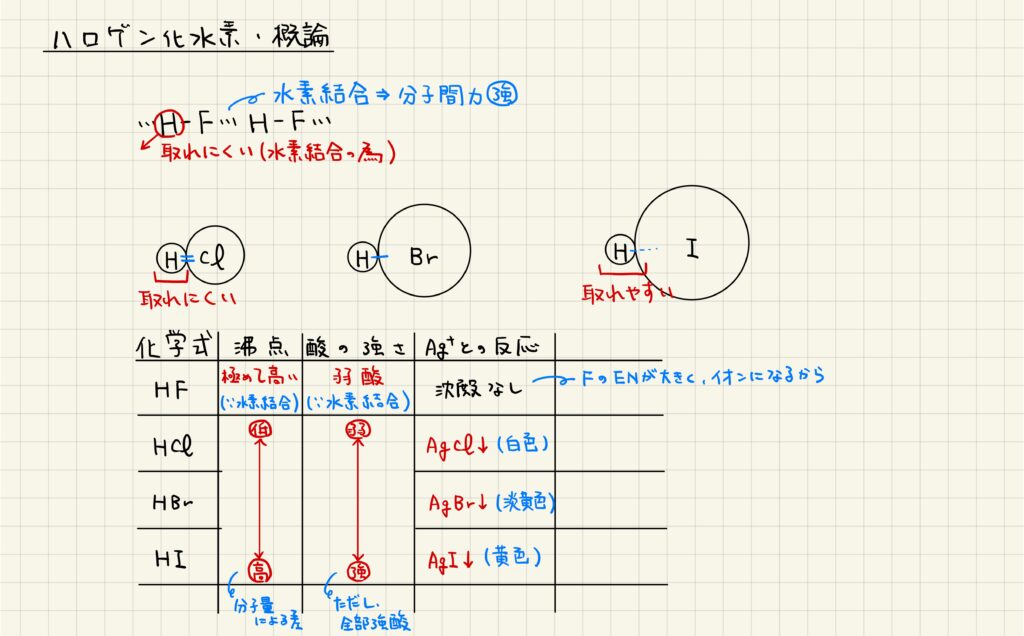
ハロゲン化水素は,HFとそれ以外とで性質が大きく異なります。HFは分子間で水素結合を形成するため,融点・沸点が非常に高いです。また,水素結合により水素イオンが電離しづらく,弱酸として働きます。ハロゲン化物イオンは銀イオンと沈殿を作ることが多いですが,AgFは水に可溶となっています。

先述したように,HFは弱酸として働きます。それ以外のハロゲン化水素は強酸として働きますが,原子番号が大きくなるほど酸として強くなります。これは,原子番号が大きいハロゲン化物イオンの方が水素との結合が弱く,電離しやすいからです。
また,還元力では原子番号が大きいほど強くなっています。これは,原子番号が大きいハロゲン化物イオンの方が電子を引きつける力が弱く,電子を放出しやすいからです。
【ハロゲン化水素の反応】
HFの反応

HFはホタル石に濃硫酸を加えて加熱することで得られます。ホタル石の主成分はフッ化カルシウムで,この反応の反応機構は揮発性酸の遊離となります。不揮発性の濃硫酸を加えながら加熱することで,揮発性の酸であるフッ化水素を得る方法です。この時,硫酸カルシウムは沈殿していくので,硫酸の電離が進行し,完全に電離します。

HFはガラスの主成分である二酸化ケイ素と反応し,溶解します。ただし,この反応はフッ化水素の状態によって反応性が異なることに注意が必要です。気体のフッ化水素を用いた場合は四フッ化ケイ素が生じますが,水溶液のフッ化水素酸を用いた場合にはヘキサフルオロケイ酸が生じます。
HClの反応

HClは強酸として有名な物質ですが,食塩に濃硫酸を加えて加熱することで生成します。この反応も反応機構は揮発性酸の遊離です。ただし,この反応では硫酸ナトリウムが沈殿しないため,電離が進行しづらく,硫酸水素ナトリウムが生じることになります。
【ハロゲン化銀】
ハロゲン化銀の感光性
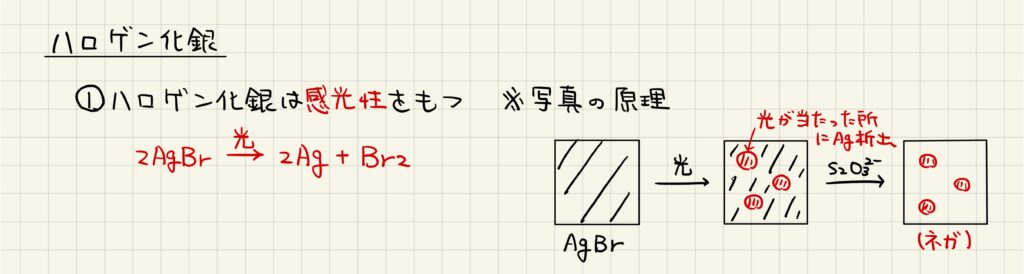
ハロゲン化銀の性質として,感光性が知られています。感光性とは,光を触媒として反応が進行する性質です。古くはこの性質を利用して,写真が現像されていました。
ハロゲン化銀の溶解性
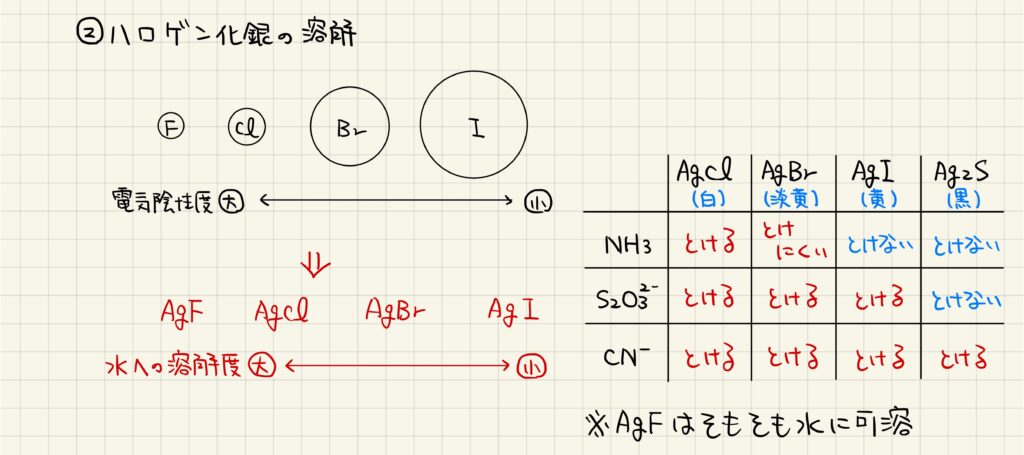
ハロゲン化銀はAgFを除いて水に不溶であるため,基本的には沈殿として扱われます。しかし,特定の溶液を加えることで銀イオンが錯イオンを形成し,再溶解します。ハロゲン化銀の中ではヨウ化銀が最も溶解しづらいですが,それでもシアン化物イオンを加えることで再溶解します。