このページのまとめ
学習のポイント
- ハロゲンの単体は酸化剤として働き、原子番号が小さいほど酸化力が強い。
- 塩素の発生方法として、二酸化マンガンに濃塩酸を加える方法や、さらし粉に希塩酸を加える方法が知られている。
- ヨウ素はヨウ化カリウム水溶液にとけてヨウ素溶液となり、デンプンと反応して青紫色に呈色する。
まとめノート

このページでは,ハロゲンの単体について解説していきます。ハロゲンは元素周期表における第17族元素の総称で,一般に原子は電子を一つ受け取って一価の陰イオンになりやすいという性質があります。また,共有結合をすることで分子を作り,二原子で単体を形成します。ハロゲンの単体は酸化剤として働く場合が多く,様々な反応性を有しています。
【ハロゲンの単体・概論】
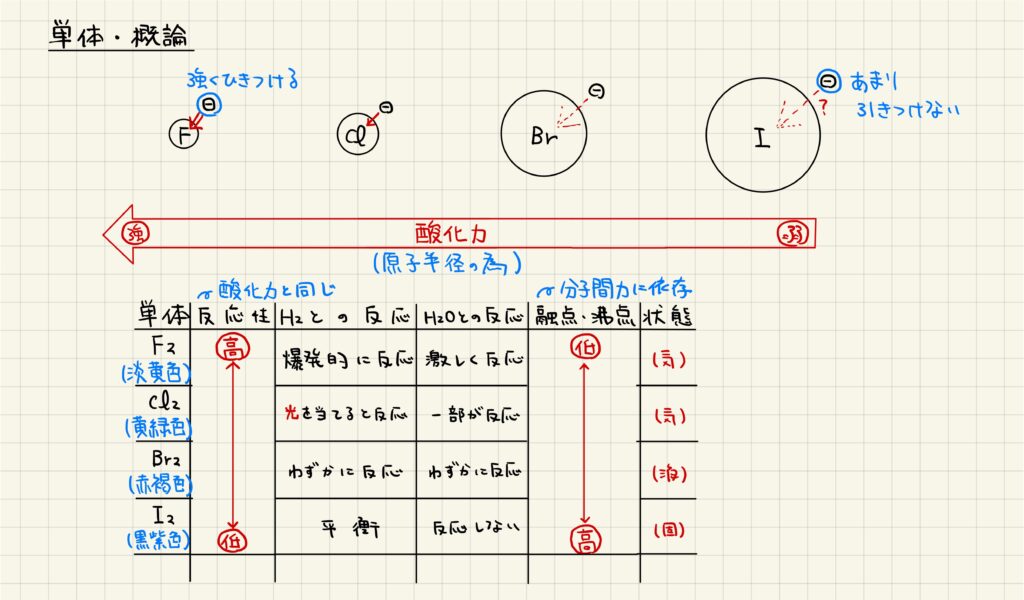
ハロゲン原子は,原子番号によってその大きさが異なります。原子番号が大きいほど原子半径が大きくなります。原子半径が大きくなるほど電子を引きつける力が弱くなるので,電子を引きつける力(酸化力)はフッ素が最も大きく,ヨウ素が最も小さいことになります。したがって,反応性は原子番号順に小さくなります。
ハロゲンの単体はそれぞれ異なる色・状態を示します。常温において,F2は淡黄色の気体,Cl2は黄緑色の気体,Br2は赤褐色の液体,I2は黒紫色の固体となります。ハロゲンの単体の融点・沸点は分子間力に依存し,分子間力は分子量に影響されるので,原子番号が小さいものほど融点・沸点は低くなります。
【ハロゲンの単体・各論】
F2の反応

F2は,非常に強い酸化剤として働きます。水素と爆発的に反応してフッ化水素を生じる他,水とも激しく反応します。また,水との反応では酸素が酸化されるという珍しい現象が起きています。これは,電子を引きつける力が酸素よりもフッ素の方が強い為です。
Cl2の反応
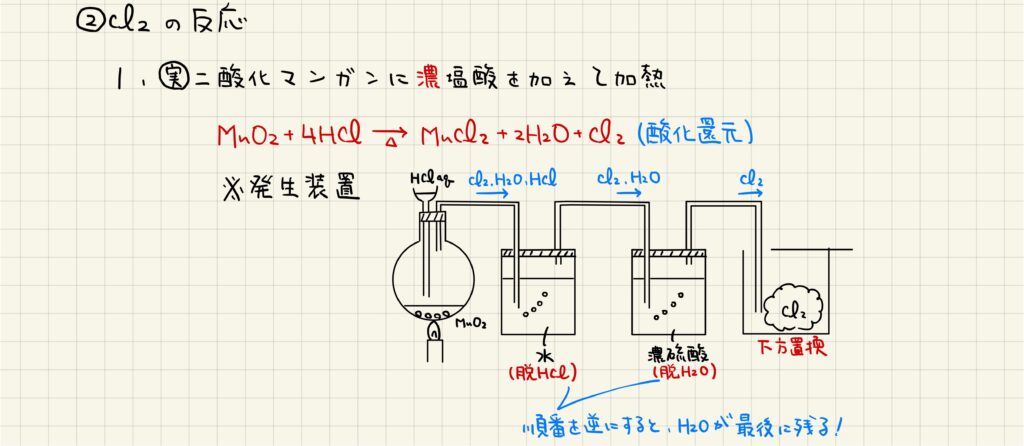
Cl2の実験室的な製法として,二酸化マンガンに濃塩酸を加えることが知られています。この酸化還元反応により,塩素の単体が生成されます。また,この反応においては実験装置も重要です。二酸化マンガンと濃塩酸を反応させて得られる気体には塩素の他に塩化水素や水蒸気を含んでいるため,水に通すことで塩化水素を除き,濃硫酸に通すことで水蒸気を除きます。尚,水と濃硫酸の順序を逆にすると最後に水蒸気が混ざってしまうため,実験操作としては不適切となります。

Cl2の実験室的な製法として,さらし粉に希塩酸を加える方法も知られています。さらし粉は塩化物イオンと次亜塩素酸イオンを含む複塩ですので,化学式を覚えておきましょう。
Cl2の反応としては,光を触媒として水素と反応することが知られています。この反応により,塩化水素が生じます。また,水と一部が反応し,塩化水素と次亜塩素酸が生じます。次亜塩素酸は塩素のオキソ酸の一種で,酸化力があるため殺菌・漂白作用を示します。
一般に,オキソ酸の酸の強さ・酸化力は酸素原子が増加するにしたがって強くなっていきます。塩素の場合は,過塩素酸が最も酸として,酸化剤として強いことになります。
Br2の反応

Br2の反応はあまり重要ではありませんが,水とわずかに反応することを覚えておけば十分でしょう。
I2の反応
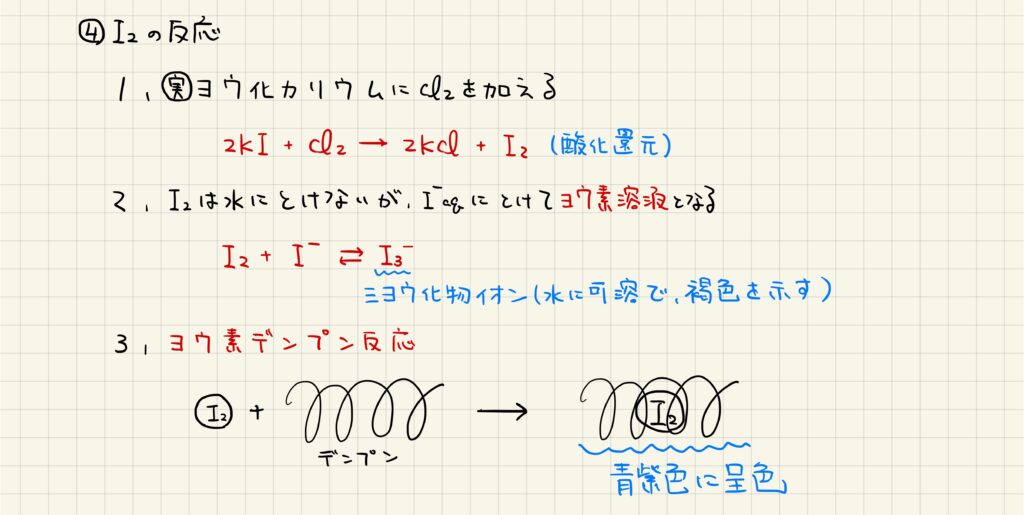
I2は,実験室ではヨウ化カリウム水溶液に塩素の単体を加えることで生成されます。塩素の方が陰イオンになる力が強いため,塩素がイオンになり,代わりにヨウ素の単体が得られます。
また,ヨウ素の単体はヨウ化物イオンと反応し,三ヨウ化物イオンになります。この三ヨウ化物イオンを含む水溶液をヨウ素溶液と呼び,褐色を示します。ヨウ素の単体はデンプンとヨウ素デンプン反応を示し,青紫色に呈色します。この反応は酸化還元滴定などに用いられています。